
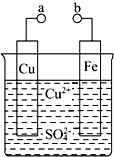
 某小组为研究电化学原理,设计如图装置.请回答下列问题:
某小组为研究电化学原理,设计如图装置.请回答下列问题:分析 (1))a和b不连接时,会发生金属的化学腐蚀,根据化学反应知识来回答;
(2)a和b用导线连接时,形成原电池的工作原理,根据原电池的工作原理来回答;
(3)根据电镀池的工作原理来回答.
解答 解:(1))a和b不连接时,会发生金属铁的化学腐蚀,发生反应为:Fe+Cu2+=Fe2++Cu,此时化学能转化为热能,故答案为:Fe+Cu2+=Fe2++Cu;热;
(2)a和b用导线连接时,形成原电池的工作原理,此时活泼金属铁为负极,金属铜为正极,外电路中的电子是从负极流向正极,在电解质中,阳离子移向阴极,阴离子移向阳极,故答案为:Fe;SO42-;Cu2++2e-=Cu;
(3)根据电镀池的工作原理:镀层金属Cu做阳极,要和直流电源的正极相连,发生失电子的氧化反应,Cu-2e-=Cu2+,镀件Fe作阴极,发生得电子的还原反应,故答案为:正极;Cu-2e-=Cu2+.
点评 本题考查学生化学反应与原电池反应,明确原电池的工作原理及所发生的氧化还原反应是解答本题的关键,电解过程的反应原理应用,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 同一反应中,各个物质的反应速率相同 | |
| B. | 反应速率只与物质的量有关 | |
| C. | 同一反应中,各个物质的反应速率可能相同 | |
| D. | 反应速率的符号是Vm |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B的氧化物对应的水化物为强酸 | |
| B. | F单质与C单质反应的产物只有一种 | |
| C. | 因为E单质相对于分子质量小于溴单质相对分子质量,所以E单质的熔点比溴单质要低 | |
| D. | A、D形成化合物的水溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电极a是负极 | |
| B. | 电极b上的电极反应为O2+2H2O+4e-=4OH- | |
| C. | 外电路中电子由电极b流向电极a | |
| D. | 氢氧燃料电池的优点是高效、对环境友好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在101kPa下,1g物质完全燃烧所放出的热量叫该物质的热值,单位为kJ•mol-1 | |
| B. | 某放热反应在其它条件不变时,加入催化剂后反应速率加快,同时会放出更多的热量 | |
| C. | C5H12(l)+8O2(g)═5CO2(g)+6H2O(g)△H1;C5H12(g)+8O2(g)═5CO2(g)+6H2O(l)△H2.反应热△H1>△H2 | |
| D. | 500℃、30MPa 下,将 0.5mol N2(g)和 1.5molH2(g)置于密闭容器中充分反应生成 NH3(g)放热 19.3 kJ,其热化学方程式为: N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
 Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2.
Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com