
| A. | 该溶液中由水电离出的c(OH-)=10a-14 | |
| B. | 加水稀释,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}$减小 | |
| C. | 该温度下,pH=a的NaOH溶液的物质的量浓度小于0.1mol•L-1 | |
| D. | 加入等浓度、等体积的CH3COOH溶液,所得溶液中c(CH3COO-)+c(CH3COOH)=2c(Na+) |
分析 A.CH3COONa溶液中氢离子和氢氧根离子均由水电离;
B.水解常数只受温度影响;
C.0.1mol•L-1CH3COONa溶液的pH=a,a小于13;
D.根据物料守恒分析.
解答 解:A.CH3COONa溶液中氢离子和氢氧根离子均由水电离,已知溶液的pH=a,则c(H+)=10-a,所以c(OH-)=10a-14,故A正确;
B.0.1mol•L-1CH3COONa溶液中水解常数Kh=$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}$,水解常数只受温度影响,温度不变,所以水解常数不变,故B错误;
C.0.1mol•L-1CH3COONa溶液的pH=a,a小于13,则c(OH-)小于0.1mol•L-1,所以pH=a的NaOH溶液的物质的量浓度小于0.1mol•L-1,故C正确;
D.0.1mol•L-1CH3COONa溶液中加入等浓度、等体积的CH3COOH溶液,CH3COONa和CH3COOH的总浓度 是钠离子浓度的2倍,即c(CH3COO-)+c(CH3COOH)=2c(Na+),故D正确.
故选B.
点评 本题考查pH的计算、盐类水解原理,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握盐的水解原理、溶液pH的计算方法,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
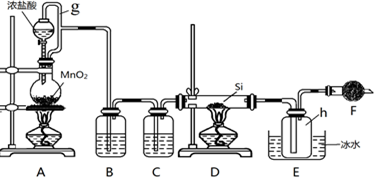
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
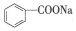 ,缩写为NaA)可用作饮料的防腐剂.研究表明苯甲酸(HA)的抑菌能力显著高于A-.已知25℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11.在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体.下列说法正确的是(温度为25℃,不考虑饮料中其他成分)( )
,缩写为NaA)可用作饮料的防腐剂.研究表明苯甲酸(HA)的抑菌能力显著高于A-.已知25℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11.在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体.下列说法正确的是(温度为25℃,不考虑饮料中其他成分)( )| A. | 相比于未充CO2的饮料,碳酸饮料的抑菌能力较低 | |
| B. | 提高CO2充气压力,饮料中c(A-)不变 | |
| C. | 当pH为5.0时,饮料中$\frac{c(HA)}{c({A}^{-})}$=0.16 | |
| D. | 碳酸饮料中各种粒子的浓度关系为:c(H+)=c(HCO${\;}_{3}^{-}$)+2c(CO${\;}_{3}^{2-}$)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
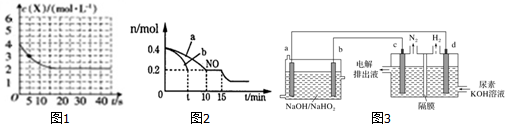
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
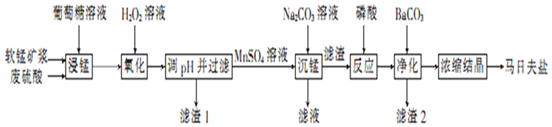
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.8 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
| Mn2+ | 7.8 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成0.1NA根共价键 | B. | 消耗反应物总体积2.24L | ||
| C. | 转移了2NA个电子 | D. | 产物溶于水后,溶液pH=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com