
在水溶液中能大量共存的一组是
A.Ba2+、Na+、SO42—、Cl— B.MnO4—、SO32—、H+、K+
C.AlO2—、Mg2+、K+ 、HCO3— D.K+、 Na+、 NO3— 、SO42—
科目:高中化学 来源: 题型:
进行一氯取代反应后,只能生成三种沸点不同的产物的烷烃是( )
A.(CH3)2CHCH2CH2CH3
B.(CH3CH2)2CHCH3
C.(CH3)2CHCH(CH3)2
D.(CH3)3CCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,常用于水的消毒以及纺织高漂白。过氧化氢法生产亚氯酸钠的流程图如下
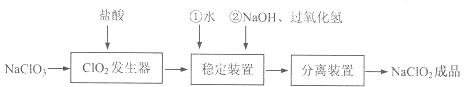
已知NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O且NaClO2在碱性条件下稳定性较高。试回答下列问题:
(1)在ClO2发生器中同时有氯气产生,则在发生器中发生反应的化学方程式为
(2)在NaClO2稳定装置中,H2O2作 (选填序号)。
A.氧化剂 B.还原剂
C.既作氧化剂又作还原剂 D.既不作氧化剂也不作还原剂
(3)在实验室模拟“固体分离装置”中的技术,必须进行的实验操作是 (按实验后顺序填写操作代号)。
A.过滤 B.加热 C.分液 D.蒸馏 E.冷却
(4)经查阅资料知道:当pH≤2.0时,ClO-2能被I完全还原成Cl—;
溶液中Na2S2O3能与I2反应生成NaI和Na2S4O6。
欲测定成品中NaClO2的含量,现进行如下操作:

①步骤Ⅱ中发生反应的离子方程式是 ,
步骤Ⅲ中达到滴定终点时的现象是 。
②若上述滴定操作中用去了V mL Na2S2O3溶液,则样品中NaClO2的质量分数 (用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某pH= 1的X溶液中可能含有Fe2+、A13+、NH4+、CO32-、SO32-、SO42-、Cl-中的若干种,现取X溶液进行连续实验。实验过程及产物如下:
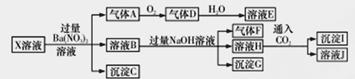
下列说法正确的是
A.气体A是NO2和SO2的混合气体
B.X中肯定存在Fe2+、NH4+、SO42-
C.溶液E和气体F不能发生化学反应
D.X中不能确定的离子是SO32-和Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
有一瓶无色溶液,其中可能含有NH4+、K+ 、Mg2+、Ba2+、Al3+ 、Fe3+、I-、Cl-、NO3-、CO32-、SO42-取该溶液进行以下实验:
①该溶液可使pH试纸呈红色;
②取少量溶液加新制氯水及CCl4振荡,可见CCl4层呈现紫色;
③取少量溶液加氯化钡溶液,有白色沉淀生成,加人HNO3后沉淀不溶解;
④取实验③之上层清液,加入硝酸银溶液有白色沉淀生成,加入HNO3后沉淀不溶解;
⑤取少量原溶液加入NaOH溶液呈碱性,在此过程中有白色沉淀生成,而后又逐渐消失,将此溶液加热,有无色气休放出,该气体能使润湿的红色石蕊试纸变蓝。
根据上述实验事实,溶液中肯定存在的离子有_____________________,肯定不存在的离子有_____________________,不能确定是否存在的离子有_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物A含硫(每个分子只含一个硫原子)、氧以及一种或几种卤素;少量A与水反应可完全水解而不被氧化或还原,所有反应产物均可溶于水;将A配成水溶液稀释后分成几份,分别加入一系列的试剂,现象如下:
①加入硝酸和硝酸银,产生白色沉淀;
②加入氯化钡溶液,无沉淀生成;
③溶液经酸化后加入高锰酸钾溶液,紫色褪去,再加入硝酸钡溶液,产生白色沉淀;
(1)由此判断组成该化合物的元素中,可能存在的卤素有____________,A与水反应后生成的溶液中含有的离子可能有_________________________。
(2)要确定该化合物的分子式,称取11.90g A溶于水稀释至250.0mL,取25.00mL溶液加入足量的高锰酸钾溶液和硝酸钡溶液,使沉淀完全,沉淀经洗涤、干燥后称重,为2.33g,试确定A的化学式,写出计算过程。
查看答案和解析>>
科目:高中化学 来源: 题型:
次氯酸钠(NaClO)和藏氯酸钠(NaClO)都是重要的含氯消毒剂。
(l) NaClO2中,氯元素的化合价为________。
(2)某同学在实验室探究并制作一种家用环保型消毒液(NaClO)发生器,设计了如图的装置,用石墨作电极电解饱和氯化钠溶液。
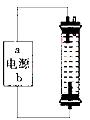
①通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,则电源有b电极名称为_________(填“正”、“负”、“阴”或“阳”)投。
②装置中发生反应的有关化学方程式为________; 充分电解后溶液中各离子浓度由大到小顺序为____________。
③请说出使用该装置生产消毒液的一个优点和一个注意事项____ 。
(3)化学课外活动小组为测定某品牌“84消毒液”中NaClO的含量(单位体积溶液含有 NaCIO的质量),做了如下实验。已知:
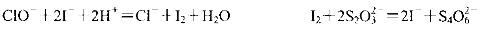
取10 mL该消毒液于锥形瓶中,迅速加入适量的硫酸酸化的碘化钾溶液,密封、充分
混合,暗处放置几分钟。然后加入几滴淀粉溶液,用c mol/L的硫代硫酸钠(Na2S2O3)
标准溶液滴定,平均用去VmL硫代硫酸钠溶液。则该“84消毒液”中NaCIO的含量
为_________g/mL(用含c、V的式子表示)。
(4)以下是过氧化氢法生产亚氯酸钠的工艺流程图:
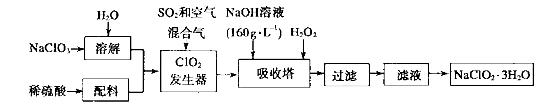
己知:(i)NaClO2 的溶解度随温度升高而增大,适当条件下可结晶析出: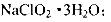
(ii)纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下较安全;
(iii) HClO2可看成是强酸。
①发生器中发生反应的离子方程式为___________________在发生器中鼓入空气的作用可能是__________________。
②吸收塔内的反应的化学方程式为__________________。在吸收塔中为防止被还原成NaCI,所用还原剂的还原性应适中。除外,还可以选择的还原剂_________(填序号)。
A.Na2O2 B.Na2S C.FeCl2
③从滤液中得到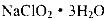 粗晶体的实验操作依次是_________(填序号)。
粗晶体的实验操作依次是_________(填序号)。
A.蒸馏 B.蒸发 C.灼烧 D.过滤 E.冷却结晶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com