
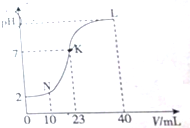
| A. | K点时的溶液:n(A-)=n(M+)=2×10-4 mol | |
| B. | N点时的溶液:2c(M+)=c(A-) | |
| C. | L点时的溶液中一定存在:c(M+)>c(A-)>c(OH-)>c(H+) | |
| D. | 水电离的程度:K>L>N |
分析 由图象可知,0.01 mol•L-1 HA溶液的pH=2,故酸HA为强酸,当加入20mL0.01mol/L的MOH溶液时,两者恰好完全反应,此时溶液显酸性,说明MOH为弱碱.
A、K点时,溶液显中性,溶液中n(OH-)=n(H+),根据溶液的电中性来分析;
B、在N点时,HA酸的物质的量是MOH的二倍,混合时HA过量,混合后所得溶液是等浓度的HA和MA的混合溶液,根据物料守恒来分析;
C、在L点时,MOH的物质的量是HA的二倍,故所得混合溶液中是MA和等物质的量的MOH的混合溶液;
D、酸和碱对水的电离有抑制作用,盐的水解对水的电离有促进作用.
解答 解:由图象可知,0.01 mol•L-1 HA溶液的pH=2,故酸HA为强酸,当加入20mL0.01mol/L的MOH溶液时,两者恰好完全反应,此时溶液显酸性,说明MOH为弱碱.
A、K点时,溶液显中性,溶液中n(OH-)=n(H+),根据溶液的电中性可知:n(A-)=n(M+)=2×10-4mol,故A正确;
B、在N点时,HA酸的物质的量是MOH的二倍,混合时HA过量,混合后所得溶液是等浓度的HA和MA的混合溶液,而M+会部分水解为MOH,根据物料守恒有:2[c(M+)+c(MOH)]=c(A-),故B错误;
C、在L点时,MOH的物质的量是HA的二倍,故所得混合溶液中是MA和等物质的量的MOH的混合溶液,根据溶液显碱性可知MOH的电离大于MA的水解:①MOH?M++OH->②M++H2O?MOH+H+,故溶液中的离子浓度为:c(M+)>c(A-)>c(OH-)>c(H+),故C正确;
D、酸和碱对水的电离有抑制作用,盐的水解对水的电离有促进作用,N点溶液由于HA过量而溶液显酸性,故N点溶液中水的电离被抑制,L点溶液由于MOH过量而溶液显碱性,故L点溶液中水的电离也被抑制,而K点溶液显中性,水的电离无影响,故K点水的电离程度最大;在N点的混合溶液中,c(HA)=c(MA)=$\frac{1}{3}$×10-2mol/L,由于HA是强酸,故溶液中的c(H+)=$\frac{1}{3}$×10-2mol/L,而在L点的溶液中,c(MOH)=c(MA)=$\frac{1}{3}$×10-2mol/L,但由于MOH是弱碱,且MA的存在对MOH的电离有抑制作用,故溶液中的c(OH-)<$\frac{1}{3}$×10-2mol/L,故L点溶液对水的电离的抑制较N点弱,故水电离的程度:K>L>N,故D正确.
故选B.
点评 本题考查了酸碱混合时的定性判断,注意根据酸溶液的pH和酸的浓度确定酸的强弱,为易错点,根据物料守恒和电荷守恒来分析解答.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:选择题
| A. | 根据同周期元素的第一电离能变化趋势,推出P的第一电离能比S大 | |
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正化合价都是+7 | |
| C. | 晶体中一定存在化学键 | |
| D. | 正四面体分子中键角只能是109°28′ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=1×10-7mol/L的溶液 | |
| B. | pH=pOH的溶液(pOH是OH-浓度的负对数) | |
| C. | pH=14-pOH的溶液 | |
| D. | 由等体积、等物质的量浓度的一元酸跟氢氧化钠溶液混合后所形成的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22 | B. | 21 | C. | 20 | D. | 19 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度升高,压强增大,平衡可能不移动 | |
| B. | 改变条件,A的转化率降低,平衡一定向正反应方向移动 | |
| C. | 只增大C的浓度,相当于加压,平衡向正反应方向移动 | |
| D. | 加入A,再次达平衡,C的体积分数可能降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com