
【题目】已知K2Cr2O7溶液中存在平衡:Cr2O72-+H2O ![]() 2CrO42-+2H+。K2Cr2O7为橙色,K 2CrO4为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
2CrO42-+2H+。K2Cr2O7为橙色,K 2CrO4为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
| 序号 | 试剂X |
ⅰ | 1 mL1mol·L-1 K2Cr2O7 溶液 | |
ⅱ | 1mL1 mol·L-1 K2CrO4溶液 | |
ⅲ | 5~15滴浓硫酸 | |
ⅳ | 5~15滴浓盐酸 | |
ⅴ | 5~15滴6 mol·L-1 NaOH溶液 |
Ⅰ.方案讨论
(1)ⅰ~ⅴ中依据减少生成物浓度可导致平衡移动的原理设计的是______(填序号)。
(2)已知BaCrO4为黄色沉淀。某同学认为试剂X还可设计为Ba(NO3)2溶液,加入该试剂后,溶液颜色将_____。(填“变深”、“变浅”或“不变”)。
Ⅱ.实验分析
序号 | 试剂X | 预期现象 | 实际现象 |
ⅰ | 1 mL1 mol·L-1 K2Cr2O7 溶液 | 溶液变黄 | 溶液橙色加深 |
ⅱ | 1mL1 mol·L-1 K2CrO4溶液 | 溶液橙色加深 | 溶液颜色变浅 |
ⅲ | 5~15滴浓硫酸 | 溶液橙色加深 | 溶液橙色加深 |
ⅳ | 5~15滴浓盐酸 | 溶液橙色加深 | 无明显现象 |
ⅴ | 5~15滴6mol·L-1NaOH溶液 | 溶液变黄 | 溶液变黄 |
(1)实验ⅰ没有观察到预期现象的原因是____________,实验ⅱ的原因与其相似。
(2)通过实验ⅲ和ⅴ得出的结论为___________ 。
(3)实验ⅳ无明显现象,可能的原因是____________。
(4)某同学查阅资料发现:K2Cr2O7溶液与浓盐酸可发生氧化还原反应。但实验ⅳ中没有观察到明显现象,小组同学设计了两个实验,验证了该反应的发生。
① 方案一:取5 mL浓盐酸,向其中加入15滴0.1mol·L-1 K2Cr2O7溶液,一段时间后,溶液变为绿色(CrCl3水溶液呈绿色),有黄绿色气体生成。写出该变化的化学方程式__________。
② 请你设计方案二:_______________。
【答案】ⅴ 变浅 根据平衡移动原理,实验ⅰ中,增大反应物K2Cr2O7浓度,平衡正向移动,使反应物浓度有所减少,但仍高于变化前,所以溶液橙色加深 增大(减少)生成物浓度,平衡逆向(正向)移动。(或:如果改变物质浓度,平衡就向着能够减弱这种改变的方向移动)(合理给分) 浓盐酸中氢离子浓度远小于浓硫酸中氢离子浓度 14HCl + K2CrO7=3Cl2 ↑+ 2CrCl3 + 2KCl+7H2O 向5 mL 0.1 mol·L-1 K2Cr2O7溶液中通入足量的HCl气体或以0.1 mol·L-1 K2Cr2O7溶液和浓盐酸为正负极反应物,组成双液原电池
【解析】
根据平衡移动原理及影响化学平衡移动因素判断;根据原电池工作原理解答;
Ⅰ.根据反应: Cr2O72-+H2O ![]() 2CrO42-+2H+可知:
2CrO42-+2H+可知:
(1)ⅰ加入1 mL1mol·L-1 K2Cr2O7溶液,增加的是反应物Cr2O72-浓度,平衡正向移动;
ⅱ加入1mL1 mol·L-1 K2CrO4溶液,增加的是生成物CrO42-的浓度,平衡逆向移动;
ⅲ加入5~15滴浓硫酸,增加的是生成物H+的浓度,平衡逆向移动;
ⅳ加入5~15滴浓盐酸,增加的是生成物H+的浓度,平衡逆向移动;
ⅴ加入5~15滴6 mol·L-1 NaOH溶液,消耗了生成物H+的浓度,平衡正向移动;
故合理选项为V;
(2)由K2Cr2O7为橙色,K 2CrO4为黄色,BaCrO4为黄色沉淀。向Cr2O72-+H2O ![]() 2CrO42-+2H+平衡体系中加入 Ba(NO3)2溶液,平衡正向移动,溶液颜色将变浅;
2CrO42-+2H+平衡体系中加入 Ba(NO3)2溶液,平衡正向移动,溶液颜色将变浅;
Ⅱ(1)由Cr2O72-+H2O ![]() 2CrO42-+2H+平衡可知,加入1 mL 1 mol·L-1 K2Cr2O7溶液后,增加的是反应物Cr2O72-浓度,平衡正向移动,但移动的程度很小,使得溶液中Cr2O72-浓度增加比移动消耗的Cr2O72-得浓度多,所以溶液橙色加深;答案:根据平衡移动原理,实验ⅰ中,增大反应物K2Cr2O7浓度,平衡正向移动,使反应物浓度有所减少,但仍高于变化前,所以溶液橙色加深;
2CrO42-+2H+平衡可知,加入1 mL 1 mol·L-1 K2Cr2O7溶液后,增加的是反应物Cr2O72-浓度,平衡正向移动,但移动的程度很小,使得溶液中Cr2O72-浓度增加比移动消耗的Cr2O72-得浓度多,所以溶液橙色加深;答案:根据平衡移动原理,实验ⅰ中,增大反应物K2Cr2O7浓度,平衡正向移动,使反应物浓度有所减少,但仍高于变化前,所以溶液橙色加深;
(2)实验ⅲ是加入5~15滴浓硫酸,增加的是生成物H+的浓度,平衡逆向移动;实验ⅴ是加入5~15滴6mol·L-1NaOH溶液,消耗了生成物H+的浓度,平衡正向移动;由此得出增大(减少)生成物浓度,平衡逆向(正向)移动;或:如果改变物质浓度,平衡就向着能够减弱这种改变的方向移动;
(3)实验ⅳ加入5~15滴浓盐酸,无明显现象,说明平衡没有移动,可能是浓盐酸中氢离子浓度远小于浓硫酸中氢离子浓度;
(4)①取5 mL浓盐酸,向其中加入15滴0.1mol·L-1 K2Cr2O7溶液,一段时间后,溶液变为绿色(CrCl3水溶液呈绿色),有黄绿色气体生成,该变化的化学方程式14HCl + K2CrO7=3Cl2 ↑+2CrCl3 +2KCl +7H2O;
②根据K2Cr2O7溶液与浓盐酸可发生氧化还原反应,可以用原电池反应原理检验。即向5 mL0.1 mol·L-1K2Cr2O7溶液中通入足量的HCl气体或以0.1 mol·L-1K2Cr2O7溶液和浓盐酸为正负极反应物,组成双液原电池,在负极有黄绿色气体产生,在正极溶液颜色变为绿色。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气(如图),下列对于试管内发生的反应及现象的说法正确的是:
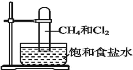
A. 为加快化学反应速率,应在强光照射下完成
B. 甲烷和 Cl2 反应后试管内壁的油状液滴物包括 CH3Cl 、CH2Cl2、CHCl3、CCl4
C. 盛放饱和食盐水的水槽底部会有少量晶体析出
D. CH4 和 Cl2 完全反应后液面上升,液体充满试管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所示有关物质检验的实验结论正确的是( )
选项 | 实验操作及现象 | 实验结论 |
A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有 |
B | 向某溶液中加入盐酸,将生成的气体通入品红溶液中,品红溶液褪色 | 该溶液一定含有 |
C | 将SO2通入Na2CO3溶液中生成的气体,先通入足量的酸性KMnO4溶液,再通入澄清石灰水中有浑浊 | 说明酸性:H2SO3>H2CO3 |
D | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述不正确的是
A. 由Na和Cl形成离子键的过程:![]()
B. Na2S做沉淀剂可处理含Hg2+的工业污水:Hg2++S2-=HgS↓
C. CH3COOH溶液与NaOH溶液反应放出热量H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
D. 闪锌矿(ZnS)经CuSO4溶液作用转化为铜蓝(CuS):ZnS+Cu2+=CuS+Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是( )

A.非金属性强弱顺序为:W>Q>Y
B.元素X与元素Z的最高正化合价之和的数值等于8
C.Z单质和W的最高价氧化物对应的水化物浓溶液不反应
D.电解熔融ZQ3可以制备Z的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性![]() >H2CO3 >
>H2CO3 >![]() >HCO3—,现要将
>HCO3—,现要将 转化为
转化为![]() 可行的方法是( )
可行的方法是( )
A. 与足量NaOH溶液共热,再通入足量HClB. 与稀硫酸共热后,加入足量的NaHCO3
C. 加热该物质溶液,再通入足量的CO2D. 加稀硫酸共热后,再加入足量NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定量硫酸亚铁和硫酸铁混合物样品溶于水,配成100mL溶液。所得溶液分成二份,在第一份溶液中加入0.5mol·L-1氯化钡220mL恰好完全反应;在第二份溶液中通入标准状况下的氯气0.896L,可使Fe2+全部变成Fe3+。
(1)所取样品中硫酸亚铁物质的量是___。
(2)在第一份溶液完全反应后的溶液中再加入足量氢氧化钠溶液,所得沉淀经洗涤后,在空气中充分灼烧,得到残渣的质量是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素的化合价与其形成物质类别的关系如图所示。下列说法错误的是( )
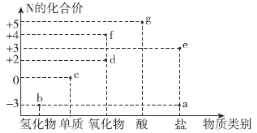
A.b与O2在一定条件下反应可以生成d
B.c既有氧化性,又有还原性
C.f的化学式一定为NO2
D.g与b可化合生成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地菱锰矿的主要成分为MnCO3,还含有少量的FeCO3、CaCO3、Al2O3等杂质。工业上以菱锰矿为原料制备高纯度碳酸锰的流程如图所示:
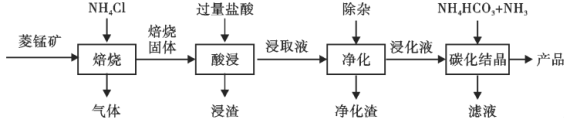
已知:MnCO3+2NH4Cl=MnCl2+CO2↑+2NH3↑+H2O.
相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 |
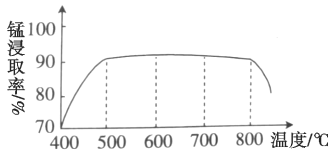
(1)焙烧时温度对锰浸取率的影响如图。焙烧时适宜的温度为___________左右;800℃以上锰的浸取率偏低,可能的原因是___________。
(2)净化包含三步:①加入少量MnO2,添加少量MnO2的作用是____________。发生反应的离子方程式为___________。
②加氨水调pH,溶液的pH范围应调节为___________~8.1之间。生成的沉淀主要是___________。
③加入MnF2,沉淀除去Ca2+,若溶液酸度过高,Ca2+沉淀不完全,原因是___________。
(3)碳化结晶中生成MnCO3的离子方程式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com