
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
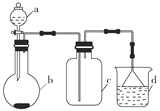
选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 浓硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
A. A B. B C. C D. D
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】取一定物质的量浓度的NaOH溶液100mL,然后向其通入一定量的CO2气体,得到溶液A,向A中逐滴缓慢加入0.1mol/L的HCl溶液,产生的CO2气体体积(标准状况)与所加HCl溶液的体积之间关系如图所示,通过计算回答:
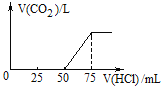
(1)A溶液中的溶质为_________(化学式),其物质的量之比是_______。
(2)通入CO2气体体积__________________(标准状况)。
(3)NaOH溶液的物质的量浓度______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质变化的描述正确的是
A.石油分馏和煤的干馏都是化学变化
B.同素异体之间的转化属于化学变化,但不属于氧化还原反应
C.通过化学变化可以实现一种原子变成另一种原子
D.金属导电和电解质溶液导电都是物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质或其主要成分的名称(或俗名)、化学式、类别一致的是 ( )
A.胆矾 CuSO4·5H2O 混合物 B.氖气 Ne 单质
C.烧碱 NaOH 氧化物 D.纯碱 NaOH 碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或对实验事实的叙述正确的是
A. 用湿润的pH试纸测定稀盐酸的pH
B. 配制FeSO4溶液时,需加入少量铁粉和稀硫酸
C. 用碱式滴定管量取 20.00 mL 0.1 mol·L-1 KMnO4溶液
D. 用带有玻璃塞的试剂瓶储存Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于蛋白质的说法中,错误的是
A.食物中的蛋白质,可以直接被人体吸收
B.氨基酸是羧酸分子中烃基上的氢原子被氨基取代的产物
C.酶本身就是蛋白质
D.多肽和蛋白质在结构上有严格区别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化钙(CaH2)是一种常用的储氢材料,也是登山运动员常用的能源提供剂,需要密封保存,遇水反应生成氢氧化钙和氢气。某研究性学习小组模拟生产企业制取氢化钙。
【实验】
用锌粒和稀硫酸反应制得干燥、纯净的氢气,再与金属钙在加热的条件下直接化合,即可制得CaH2。
(1)下列有关该实验的说法正确的是_______________。
a.其他条件相同时,粗锌制取氢气的速率比纯锌快
b.加热时,必须通入氮气作为保护气,以防止空气的干扰
c.可以用浓硫酸或碱石灰对H2进行干燥除杂
d.开始实验时,应先通入H2,后给金属钙加热
e.停止实验时,应先停止通入H2,后停止加热
【提出假设】
(2)由于实验中操作不当,金属钙或氢化钙都可能被氧化;该小组甲同学对反应后的固体产物成分提出如下假设:
假设1:含有Ca和CaH2;
假设2:含有CaH2和CaO;
假设3:含有__________________。
【设计实验方案,验证假设】
(3)定性实验用化学方法鉴别Ca与CaH2,请设计实验完成下表中内容。
实验步骤 | 预期现象和结论 |
取少量固体样品,________ |
(4)定量实验测定Ca和CaH2混合物中CaH2的质量分数。
①取m1 g样品与水完全反应,利用如图装置测定生成的气体体积时,在________时进行收集(填字母)。

a.刚开始有气泡
b.气泡连续均匀
c.气体经过验纯后,再收集
②如果装置气密性良好,操作正确,乙同学认为:由于液体加入,导致气体的体积测定偏大,则计算出氢化钙的质量分数________(填“偏高”“偏低”或“无影响”)。
【反思与交流】
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是氢化钙是固体,携带方便。既然金属钙与水反应也能生成氢气,为什么还要将金属钙制备成氢化钙呢?你的观点是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容条件下,下列叙述中不是可逆反应2A(g)+3B(g)![]() 2C(g)达到平衡的标志的是
2C(g)达到平衡的标志的是
①C的生成速率与C的分解速率相等②单位时间生成amolA,同时消耗1.5molB;③各组分的浓度不再变化;④混合气体的密度不再变化;⑤混合气体的总压强不再变化;⑥混合气体的物质的量不再变化;⑦混合气体的平均摩尔质量不再变化;⑧A、B、C的分子数目比为2: 3: 2.
A. ⑤⑥⑧ B. ②⑤⑧ C. ①③④ D. ②④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对化学反应中的能量变化解决下列问题。
(1)测定稀硫酸和稀氢氧化钠中和热(中和热为57.3 kJ.mor1)的实验装罝如图所示。
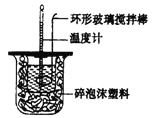
某兴趣小组的实验数值结果小于57.3 kJ/mol,原因可能是________(填字母)。
A.实验装罝保温、隔热效果差
B.读取混合液的最高温度记为终点温度
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后未洗涤,直接测定H2SO4 溶液的温度
(2)利用氢气可以制取工业原料乙酸。己知:
A.CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H=-870.3kJ/mo1
B.C(s)+O2(g)=CO2(g) △H=-393.5kJ/mo1
C.H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ/mo1
①相同质量的CH3COOH、C、H2完全燃烧时,放出热量最多的是___________。
②利用上述信息计算下述反应:2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H= kJ/mol 。
(3)用Cl2生产某些含氯有机物时会产生副产物HC1。利用反应A,可实现氯的循环利用。
反应 A: 4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
(1)已知:ⅰ.反应A中,4 molHCl被氧化,放出115.6 kJ的热量。
![]()
ⅱ.![]()
①写出此条件下反应A的热化学方程式是________________。
断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为________kJ。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com