
【题目】
砷主要以硫化物矿的形式(如雄黄,雌黄等)存在于自然界。砷及其化合物主要用于合金冶炼、农药医药、颜料等工业。请根据有关砷及其化合物的转化关系和晶体结构图,回答下列问题:

(1)量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道,电子除空间运动状态外,还有一种运动状态叫做__________________。
(2)基态砷原子的核外电子排布式为_______________,与砷同周期的p区元素中第一电离能大于砷的元素有_______________ (填元素符号)。
(3)雄黄分子中,As原子的杂化方式为_________________。
(4)雄黄可经过如下三步反应生成雌黄:

①反应Ⅲ的化学方程式为________________________。
②SO2的中心原子的VSEPR构型为______________________。
③亚砷酸属于三元弱酸,酸性:H3AsO3________HNO2(填“>”或“<”),请根据物质结构的知识解释原因:____________________________。
(5)①图3是由Li、Fe和As三种元素组成的超导体化合物的晶体结构(该晶胞是立方晶胞,Li在晶胞内部),该晶体的化学式为_____________________。
②若1号原子的坐标为(0,0,0),2号原子的坐标为(1/4,1/4,1/3),则3号原子的坐标为___________。
③已知该晶胞参数ɑ=0.53nm,阿伏加德罗常数的值为NA,则该晶体的密度为_______g·cm-3(列出计算式即可)。
【答案】 自旋 1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3 Br、Kr sp3 2H3AsO3+3H2S=As2S3+6H2O 平面三角形 < 氮的电负性强于砷另外H3AsO3的结构为(HO)3As非羟基氧的个数为0HNO2的结构为(HO)NO非羟基氧的个数为1非羟基氧的个数越多中心原子的正电性越高导致羟基氧中氧的电子向中心原子偏移越容易电离出氢离子故HNO2的酸性强于H3AsO3 LiFeAs (3/4,1/4,2/3) ![]()
【解析】考查物质结构与性质综合知识的运用,(1)量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道,电子除空间运动状态外,还有一种运动状态称为自旋;(2)As位于第四周期VA族,基态核外电子排布式为1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3 ;同周期从左向右第一电离能增大,但IIA>IIIA、VA>VIA,因此第一电离能大于As元素的是Br和Kr;(3)根据雄黄的结构简式,As有3个σ键,一个孤电子对,因此As的杂化类型为sp3;(4)①根据雌黄的结构,推出雌黄的分子式为As2S3,根据III的流程,因此方程式为2H3AsO3+3H2S=As2S3+6H2O;②SO2中心原子有2个σ键,孤电子对数为(6-2×2)/2=1,价层电子对数为3,因此VSEPR模型为平面三角形;③H3AsO3为三元弱酸,不含有非羟基氧,HNO2中含有1个非羟基氧,非羟基氧越多,中心原子的正电性越高导致羟基氧中氧的电子向中心原子偏移越容易电离出氢离子故HNO2的酸性强于H3AsO3;(5)①根据晶胞的结构,Li位于晶胞内部,有4个,Fe位于顶点、棱上、面上,个数为8×1/8+8×1/4+2×1/2=4,As位于晶胞的内部,个数为4个,因此化学式为LiFeAs;②根据1号和2号原子的坐标,推出3号原子坐标为(3/4,1/4,2/3);③晶胞的质量为4×138/NAg,晶胞的体积为(0.53×10-7)3cm3,根据密度的定义,得出晶胞的密度为![]() g/cm3。
g/cm3。


科目:高中化学 来源: 题型:
【题目】研究大气中含硫化合物(主要是H2S和SO2)的转化具有重要意义。
(1)H2S资源化利用途径之一是回收能量并得到单质硫,如图为质子膜H2S燃料电池的示意图。
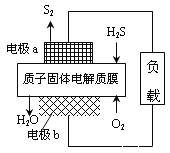
①电极a为电池的_______极,电极b上发生的电极反应为:______________________。
②每17gH2S参与反应,有_____molH+经质子膜进入_____极区。
(2)低浓度SO2废气的处理是工业难题,目前常用的方法如下:
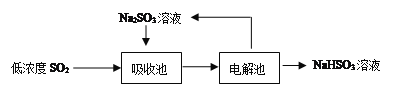
①Na2SO3溶液吸收SO2的化学方程式是____________________________________。
②如果用含等物质的量溶质的下列各溶液分别吸收SO2,则理论吸收量最多的是(____)
A.Na2SO3B.Na2S C.Ba(NO3)2 D.酸性KMnO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某再回收利用公司对一厨房铁铝合金废旧家具进行回收利用,其流程如下图所示:
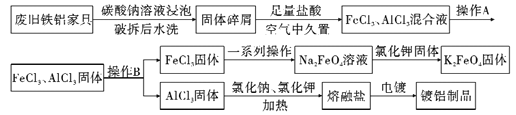
请回答下列问题:
(1)流程中加碳酸钠溶液浸泡的目的是_______________;在空气中久置的目的是_________________。
(2)同条件下Na2FeO4溶解度__________K2FeO4溶解度(填“低于”,“高于”, “不确定”),推测K2FeO4在净水方面的作用_______________。(至少答两条)
(3)已知K2FeO4水解显碱性。在洗涤K2FeO4固体时最好选用__________。
A.水 B.亚硫酸氢钠溶液 C.氢氧化钠溶液 D.先氢氧化钠溶液后乙醇
(4)熔融盐电镀中铝元素和氯元素主要以AlCl4-和Al2Cl7-形式存在,铝电镀的主要电极反应式为___________________。(写出一个电极反应即可)
(5)已知氯化铝受热易升华,气态氯化铝的密度为11.92g/L(已转化为标准状况),则气态氯化铝的分子式为______________________。
(6)氢氧化铝经常用于做药品,有两种溶解方式:可以溶解为Al3+或[Al(OH)4]-。已知25℃时氢氧化铝在pH=3和pH=10的两溶液中溶解度均为7.8×10-3g(溶液密度近似为1g/mL),则25℃下氢氧化铝的两种溶解方式的溶度积之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子垃圾中含有大量的废弃塑料和重金属,工业上可以从电子废料(电脑主板和手机废件)中提取大量的金、银和铜,每吨电子废料中能够提取出130公斤铜,0.45公斤黄金和2公斤白银,提取流程如下:

请回答下列问题:
(1)“酸溶”过程中,王水与金反应的化学方程式为________________________。
(2)“萃取”过程中,将混合液分离所需要的主要仪器为____________________,该仪器在使用前必须进行的操作为____________________________。
(3)“还原Ⅰ”制备单质Ag的过程中,发生反应的本质是Zn和AgCl在电解质HCl中形成微电池,该过程的总反应为:2AgCl+Zn=2Ag+ZnCl2,则该电池正极的电极反应式为__________________________。
(4)滤渣的主要成分为Cu2(OH)2CO3,则“沉铜”过程中发生反应的离子方程式为______________________。
(5)滤液为NaCl、Na2CO3和NaHCO3的混合液,若上述三种物质的物质的量浓度相同,则溶液中各离子浓度的大小顺序为______________________。
(6)根据下表中数据,综合分析工业上进行“还原Ⅱ”过程中所选用的还原剂最好为______________。
物质 | 价格(元·吨-1) |
双氧水(含30%H2O2) | 3200 |
绿矾(含99.0%FeSO4·7H2O) | 1800 |
亚硫酸氢钠(含99.5%NaHSO3) | 2850 |
草酸(含99.0%H2C2O4) | 3000 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氧化还原反应的叙述中,正确的是( )
A.一定有氧元素参加
B.氧化反应一定先于还原反应发生
C.氧化剂本身发生氧化反应
D.一定有电子转移(得失或偏移)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在人们的日常生活、生产和环保事业中属于“明星物质”。回答下列问题:
(1)氨气是农业肥料和化工生产的重要原料,其电子式为____。
(2)叠氮化钠(NaN3)在药物制备、合成影像、化学分析、汽车制造等行业有着广泛的用途,但该物质极易爆炸,且有副毒。可用NaClO溶液对含有叠氮化钠的溶液进行处理,生成一种无污染的气体单质,反应的化学方程式为______________。
(3)“固氮”是农业科学家研究的永恒主题。在某特殊催化剂和光照条件下,N2与水反应可生成NH3。
已知:
(i)4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H1=-1266 kJ/mol;
2N2(g) +6H2O(g) △H1=-1266 kJ/mol;
(ii)H2O(g)=H2O(l) △H2= -44.0kJ/mol。
则2N2(g) +6H2O(l)![]() 4NH3(g)+3O2(g) △H3=______kJ/mol。
4NH3(g)+3O2(g) △H3=______kJ/mol。
(4)目前“人工固氮”最成功的应用就是工业合成氨:
N2(g) +3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol。将1.00molN2和3.00molH2充入到容积为3L的恒容密闭容器中,发生上述反应。
2NH3(g) △H=-92.4kJ/mol。将1.00molN2和3.00molH2充入到容积为3L的恒容密闭容器中,发生上述反应。

①图甲是测得X、Y 的浓度随时间变化的曲线.其中Y 为_____(写化学式),反应达到平衡时的平均反应速率v(N2) =_________。
②在不同温度和压强下,平衡体系中NH3的体积分数与温度、压强关系如图乙,则压强p1_____p2(填“>”“<”“=”或“不确定”,下同),B、D 两点的平衡常数KB____KD,B 点N2 的转化率=_________(保留3位有效数字)。
(5)“绿水青山就是金山银山”,利用原电池原理(6NO2 +8NH3=7N2+12H2O)可以处理氮的氧化物和NH3 尾气,装置原理图如图丙:

负极反应式为__________,当有标准状况下4.48 L NO2被处理时,转移电子的物质的量为_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知分解反应2N2O5(g)![]() 4NO2(g) + O2(g)的速率方程式v = k·cm(N2O5),k是与温度有关的常数,实验测定340K时的有关数据及根据相关数据做出的图像如下:
4NO2(g) + O2(g)的速率方程式v = k·cm(N2O5),k是与温度有关的常数,实验测定340K时的有关数据及根据相关数据做出的图像如下:
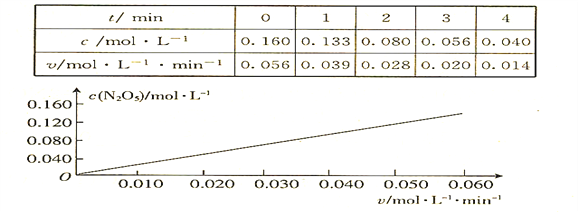
依据图表中的有关信息,判断下列有关叙述中不正确的是
A. 340K时,速率方程式中的m = 1
B. 340K时,速率方程式中的k = 0.350 min-1
C. 340K时,c(N2O5)= 0.100 mol·l-1时,v = 0.035 mol·l-1 ·min-1
D. 340K时,压强增大一倍,逆反应速率不变,正反应速率是原来的2倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com