
【题目】为了有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物含量、使用清洁能源显得尤为重要。
(1)已知:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) H = -905.48 kJ·mol-1
4NO(g)+6H2O(g) H = -905.48 kJ·mol-1
N2(g)+O2(g)![]() 2NO(g) H = +180.50 kJ·mol-1
2NO(g) H = +180.50 kJ·mol-1
则4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g)的H = 。
5N2(g)+6H2O(g)的H = 。
(2)某化学小组查阅资料知2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
第一步:2NO(g)![]() N2O2(g) (快) H1<0 v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
N2O2(g) (快) H1<0 v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
第二步:N2O2(g)+O2(g)![]() 2NO2(g) (慢) H2< 0
2NO2(g) (慢) H2< 0
v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)
① 2NO(g)+O2(g)![]() 2NO2(g)的反应速率主要是由_______(填“第一步”或“第二步”)反应决定。
2NO2(g)的反应速率主要是由_______(填“第一步”或“第二步”)反应决定。
② 一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K= ;升高温度,K值 (填“增大”、“减 小”或“不变”)
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K= ;升高温度,K值 (填“增大”、“减 小”或“不变”)
(3)利用活性炭涂层排气管处理NOx的反应为:xC(s)+2NOx(g)![]() N2(g)+xCO2(g) △H <0;理论上,适当增加汽车排气管(内壁为活性炭涂层)长度______(填“能”或“不能”)使NOx更加有效地转化为无毒尾气而排放,其原因是 。
N2(g)+xCO2(g) △H <0;理论上,适当增加汽车排气管(内壁为活性炭涂层)长度______(填“能”或“不能”)使NOx更加有效地转化为无毒尾气而排放,其原因是 。
(4)一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应: C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示,则800℃时,反应达平衡时CO2的转化率为________(保留一位小数)。
2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示,则800℃时,反应达平衡时CO2的转化率为________(保留一位小数)。

(5)氢气是一种重要的清洁能源,Mg2Cu是一种储氢合金。350℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为 。
【答案】(1)-1807.98kJ·mol-1;
(2)①第二步;②![]() ,减小;
,减小;
(3)能,增加排气管长度,增大了NOx与活性炭涂层的接触面积,能加快化学反应速率,使反应更充分;
(4)86.9%;(5)2Mg2Cu+3H2![]() MgCu2+3MgH2。
MgCu2+3MgH2。
【解析】
试题分析:(1)①4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),②N2(g)+O2(g)
4NO(g)+6H2O(g),②N2(g)+O2(g)![]() 2NO(g),①-5×②得出4NH3(g)+6NO(g)
2NO(g),①-5×②得出4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) △H=(-905.48-180.5×5)kJ·mol-1=-1807.98kJ·mol-1;(2)①反应慢的决定反应速率;②根据平衡常数的表达式,K=c2(NO2)/(NO2)/[c2(NO)×c(O2)]=
5N2(g)+6H2O(g) △H=(-905.48-180.5×5)kJ·mol-1=-1807.98kJ·mol-1;(2)①反应慢的决定反应速率;②根据平衡常数的表达式,K=c2(NO2)/(NO2)/[c2(NO)×c(O2)]= 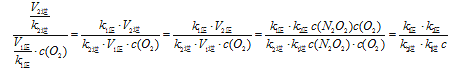 ;正反应是放热反应,升高温度,平衡向逆反应方向移动,即K减小;(3)能,增加排气管长度,增大了NOx与活性炭涂层的接触面积,能加快化学反应速率,使反应更充分;
;正反应是放热反应,升高温度,平衡向逆反应方向移动,即K减小;(3)能,增加排气管长度,增大了NOx与活性炭涂层的接触面积,能加快化学反应速率,使反应更充分;
(4)C(s)+CO2(g)![]() 2CO(g)
2CO(g)
起始: a 0
变化: x 2x
平衡: a-x 2x,
因此有2x/(a-x+2x)×100%=93%,解得a/x=0.93/1.07,即CO2的转化率为86.9%;(5)Mg比铜活泼,因此得到氢化物是氢和镁,根据物质的量之比:(1-0.077)/24:0.077/1≈1:2,化学式为MgH2,反应方程式为:2Mg2Cu+3H2![]() MgCu2+3MgH2 。
MgCu2+3MgH2 。


科目:高中化学 来源: 题型:
【题目】青蒿酸是合成青蒿素的原料,可以由香草醛合成:
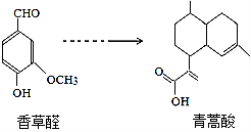
下列叙述正确的是( )
A.青蒿酸分子C15H14O2
B.在一定条件,香草醛可与HCHO发生缩聚反应
C.两种物质分别和H2反应,最多消耗H2 依次为4 mol和3 mol
D.可用FeCl3溶液或NaHCO3溶液鉴别化合物香草醛和青蒿酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件后发生下列反应能够导致固体物质增重的是( )
A. 铝与Fe2O3发生铝热反应 B. 将锌粒投入Cu(NO3)2溶液
C. 氢气通过灼热的CuO粉末 D. 二氧化碳通过Na2O2粉末
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
(l)冶炼废水中砷元素主要以亚砷酸(H3 AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:

已知:I .As2 S3与过量的S2一存在以下反应:As2S3(s)+3S2—(aq)![]() 2AsS33—(aq);
2AsS33—(aq);
II.亚砷酸盐的溶解性大于相应砷酸盐。
①亚砷酸中砷元素的化合价为 ;
②砷酸的第一步电离方程式为 ;
③“一级沉砷”中FeSO4的作用是 ;
④“二级沉砷”中H2O2与含砷物质反应的化学方程式为 ;
⑤沉淀X为 (填化学式)。
(2)冶炼废渣中的砷元素主要以As2O3的形式存在,可用古氏试砷法半定量检测(As的最低检出限为3.0×10 -6g)。
步骤1:取10 g废渣样品,粉碎后与锌粉混合,加人H2 SO4共热,生成H3As气体。
步骤2:将H3As气体通人AgNO3溶液中,生成银镜和As2O3。
步骤3:取1g废渣样品,重复上述实验,未见银镜生成。
①AsH3的电子式为 ;
②步骤2的离子方程式为 ;
③固体废弃物的排放标准中,砷元素不得高于4.0×10一5g·kg一1,请通过计算说明该排放的废渣中砷元素的含量 (填“符合”、“不符合”)排放标准,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外兴趣小组探究铜与浓硫酸的反应情况.甲.乙.丙三位同学进行了下列实验:取12.8g铜片和20ml.18mol/L的浓硫酸放在圆底烧瓶中共热,直至反应完毕,最后发现烧瓶中还有铜片剩余外,同时根据所学的知识认为还有较多的硫酸剩余.
(1)请写出铜跟浓硫酸反应的化学方程式: ,
试问:为什么较多的余酸不再与铜片继续反应?简述理由: .
可以证明有余酸的实验方案是 (填写字母,错选或多选扣分).
a.再加入铁粉 b.再滴入BaCl2溶液
c.再加入银 d.再滴入Na2CO3溶液
(2)甲学生设计求余酸浓度的实验方案是测定产生气体的量.其方法有多种,请问下列方案中不可行的是 (填写字母,错选或多选扣分).
a.将产生的气体缓缓通过预先称量盛有碱石灰的干燥管,结束反应后再次称量.
b.将产生的气体缓缓通入酸性高锰酸钾溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀.
c.用排水法测定其产生气体的体积(折算成标准状况).
d.用排饱和NaHSO3溶液的方法测出其产生气体的体积(折算成标准状况).
(3)乙同学设计测定余酸浓度的实验方案是:测定反应后的混合液中Cu2+的量.在反应后的溶液中加蒸馏水稀释至100ml,加入足量Na2S溶液,充分反应后,过滤.洗涤.干燥、称量沉淀.请写出生成沉淀的离子方程式: .
(4)根据甲、乙两同学的实验方案,除测算产生气体的物质的量或反应掉的铜的物质的量外,尚缺少的测量数据是 .
(5)丙同学提出甲、乙两同学的实验方案设计的复杂,为此他设计了下列较为简易的实验方案:取出反应后的铜片,进行洗涤.干燥.称量.若称得剩余铜片的质量为Wg,测得反应后溶液的体积为Vml,请计算剩余硫酸的物质的量浓度= mol/L(用含W.V的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流表。
锌片上发生的电极反应:__________________;银片上发生的电极反应:_________________。
(2)若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47 g,试计算:
①产生氢气的体积(标准状况)___________L;
②通过导线的电量________C。(已知NA=6.02×1023mol-1,电子电荷为1.60×10-19C)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com