
【题目】常温下,在27.5 g水中溶解12.5 g CuSO45H2O,恰好达到饱和,该溶液密度为1.18 g·cm-3,求:
(1)该溶液中阴阳离子的总物质的量._________________
(2)该溶液中CuSO4的物质的量浓度(保留二位小数)。________________
(3)取出20.0 mL该溶液,加入足量Ba(OH)2溶液,反应后可得到沉淀质量多少克?(保留一位小数)____________
【答案】0.1 mol 1.5 mol·L-1 9.9 g
【解析】
CuSO45H2O溶于水后的溶质为CuSO4,溶液中的阴阳离子为Cu2+和SO42-。
(1)n(CuSO4)=![]() =0.05 mol, Cu2+和SO42-均为0.05 mol,阴阳离子总物质的量为0.05 mol+0.05 mol=0.1 mol。
=0.05 mol, Cu2+和SO42-均为0.05 mol,阴阳离子总物质的量为0.05 mol+0.05 mol=0.1 mol。
(2)溶液的体积为![]() ≈0.034 L,CuSO4的物质的量浓度为
≈0.034 L,CuSO4的物质的量浓度为![]() ≈1.5 mol·L-1。
≈1.5 mol·L-1。
(3)取出20.0 mL该溶液,含有硫酸铜的物质的量是0.02 L×1.5 mol·L-1=0.03 mol,加入足量Ba(OH)2溶液,反应后可得到沉淀硫酸钡0.03 mol,氢氧化铜0.03 mol,质量是0.03 mol×233 g·mol-1+0.03 mol×98 g·mol-1≈9.9 g。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】(1)实验测得,5g液态甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式____________________________________。
(2)己知反应N2+3H2![]() 2NH3 △H=akJ/mol。试根据下表中所列键能数据估算a的数值为______。
2NH3 △H=akJ/mol。试根据下表中所列键能数据估算a的数值为______。
化学键 | H-H | N-H | N≡N |
键能kJ/mol | 436 | 391 | 945 |
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
己知:C(s,石墨)+O2(g)=CO2(g) △Hl=-393. 5kJ/mol
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ/mol
2C2H2(g) +5O2(g) =4CO2(g) +2H2O(1) △H3=-2599kJ/mol
裉推盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应热化学方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(7分)某含有一个双键的气态烯烃和另一气态烷烃的混合气体,在同温同压下其密度是H2的13.2倍。在标准状况下将4.48L混合气体通过足量的溴水,结果溴水增重3.36g,求原混合气体中各烃的体积分数。 (注:此题必须写出过程,否则不得分)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.2 L由NaCl溶液、MgCl2溶液、CuCl2溶液组成的混合溶液中,部分离子的浓度如图所示。
(1)混合液中,NaCl的物质的量为_______mol,MgCl2的质量为_______g。
(2)该混合溶液中CuCl2的物质的量浓度为_____molL﹣1,将该混合溶液加水稀释至体积为1 L,稀释后溶液中Cu2+的物质的量浓度为_______molL﹣1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为:Fe3++Cr2+![]() Fe2++Cr3+。下列说法一定正确的是
Fe2++Cr3+。下列说法一定正确的是

A. 电池充电时,b极的电极反应式为:Cr3++e-=Cr2+
B. 电池放电时,b极的电极反应式为:Fe2+-e-=Fe3+
C. 电池放电时,Cl-从b极穿过选择性透过膜移向a极
D. 电池放电时,电路中每通过0.1 mol电子,Fe3+浓度降低0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1mol·L-1的HA溶液中逐滴加入0.1mol·L-1的烧碱溶液,溶液中水所电离的c水(H+)随加入烧碱溶液体积的变化如图所示,下列说法正确的是( )
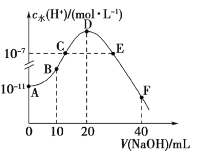
A.B点的溶液中粒子浓度之间存在:c(HA)>c(Na+)>c(A-)
B.由图可知A-的水解平衡常数Kh约为1×10-9
C.C、E两点因为对水的电离的抑制作用和促进作用相同,所以溶液均呈中性
D.F点的溶液呈碱性,粒子浓度之间存在:c(OH-)=c(HA)+c(A-)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料是人类文明进步的阶梯,第ⅢA、ⅣA、ⅤA族元素是组成特殊材料的重要元素。请回答下列问题:
(1)基态Ge原子的核外电子有__种不同的空间运动状态。
(2)P、S、Cl的第一电离能由大到小的顺序为__。
(3)M与Ga位于同周期,M3+的一种配合物组成为[M(NH3)5(H2O)]Cl3。
①下列有关NH3、H2O的说法正确的是__(填字母)。
a.分子空间构型相同
b.中心原子杂化类型相同
c.键角大小相同
②1mol[M(NH3)5(H2O)]3+含__个σ键。
③配合物T与[M(NH3)5(H2O)]Cl3组成元素的种类和数目相同,中心离子的配位数相同。1molT溶于水,加入足量AgNO3溶液可生成2molAgCl。则T的化学式为___。
(4)如图甲为硼酸晶体的片层结构,其中硼的杂化方式为__。H3BO3在热水中比冷水中溶解度显著增大的主要原因是__。
(5)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞结构如图乙所示,该晶胞中B原子相连构成几何体的空间构型为__(填“立方体”或“正四面体”或“正八面体”)。已知该晶体的密度为ρg·cm-3,NA是阿伏加德罗常数的值。BP晶胞中面心上6个P原子相连构成正八面体,该正八面体的边长为__pm(列式即可)。

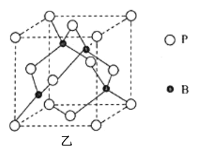
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表达,正确的是
A.钠投入水中的离子方程式: Na+2H2O=Na++2OH-+H2↑
B.一水合氨的电离方程式: NH3H2O![]() NH4++OH-
NH4++OH-
C.硫酸铜溶液和氢氧化钡溶液反应的离子方程式反应:Ba2++SO42=BaSO4↓
D.氯气溶于水的离子方程式:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3OCH3(二甲醚)常用作有机合成的原料,也用作溶剂和麻醉剂。CO2与H2合成CH3OCH3涉及的相关热化学方程式如下:
Ⅰ.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-49.1kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-49.1kJ·mol-1
Ⅱ.2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH2=-24.5kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH2=-24.5kJ·mol-1
Ⅲ.CO2(g)+H2(g)![]() CO(g)+H2(g) ΔH3
CO(g)+H2(g) ΔH3
Ⅳ.2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH4
CH3OCH3(g)+3H2O(g) ΔH4
回答下列问题:
⑴ΔH4=__kJ·mol-1。
⑵体系自由能变ΔG=ΔH-TΔS,ΔG<0时反应能自发进行。反应Ⅰ、Ⅱ、Ⅲ的自由能变与温度的关系如图a所示,在298~998K下均能自发进行的反应为__(填“Ⅰ”“Ⅱ”或“Ⅲ”)。
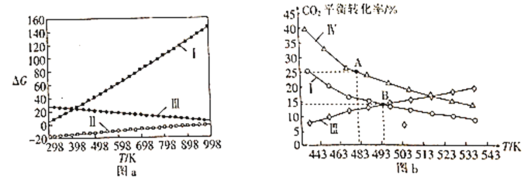
⑶在三个完全相同的恒容密闭容器中,起始时均通入3molH2和1molCO2,分别只发生反应Ⅰ、Ⅲ、Ⅳ时,CO2的平衡转化率与温度的关系如图b所示。
①ΔH3__0(填“>”或“<”)。
②反应Ⅳ,若A点总压强为pMPa,则A点时CO2的分压为p(CO2)__pMPa(精确到0.01)。
③在B点对应温度下, K(Ⅰ)__(填“大于”“小于”或“等于”)K(Ⅲ)。
⑷向一体积为1L的密闭容器中通入H2和CO2,只发生反应Ⅳ。CO2的平衡转化率与压强、温度及氢碳比m[m=![]() ]的关系分别如图c和图d所示。
]的关系分别如图c和图d所示。
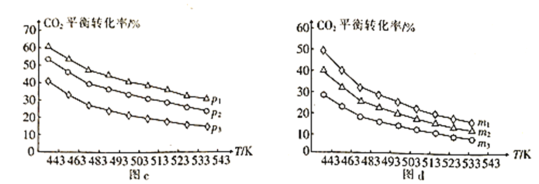
①图c中压强从大到小的顺序为__,图d中氢碳比m从大到小的顺序为__。
②若在1L恒容密闭容器中充入0.2molCO2和0.6molH2,CO2的平衡转化率为50%,则在此温度下该反应的平衡常数K=__(保留整数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com