
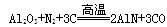 ,下列叙述正确的是 ( )
,下列叙述正确的是 ( )| A.AlN中氮的化合价为+3 |
| B.AlN的摩尔质量为41 g |
| C.上述反应中,N2是氧化剂,Al2O3 既不是氧化剂也不是还原剂。 |
| D.上述反应中,每生成1 mol AlN需转移6 mol电子 |
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.氧化还原反应中,一种元素化合价上升,一定有另一种元素化合价下降 |
| B.冰醋酸、纯碱、水玻璃分别属于酸、碱、盐 |
| C.接触法制硫酸中,为提高SO2的转化率,接触室内反应温度选定在400℃~500℃ |
| D.某物质只含有一种元素,则该物质可能为混合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②反应中SO42—都是氧化产物 | B.两个反应中电子转移数目都是10mol |
| C.①反应中的硫元素既被氧化又被还原 | D.氧化性:S2O82—>MnO4— |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.与NaOH反应的氯气一定为0.3 mol |
| B.n(Na+)∶n(Cl-)可能为7∶3 |
| C.若反应中转移的电子为n mol,则0.15 < n < 0.25 |
| D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11:2:1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.22.4 L CH3CHO中含有的分子数约为6.02×1023 |
| B.56g铁与足量稀H2SO4充分反应,转移电子数为0.3NA |
| C.常温常压下,由6 g NO2和40 g N2O4组成的混合气体中原子总数约为3×6.02×1023 |
| D.80 g NH4NO3晶体中含有NH4+小于 6.02×1023个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com