
科目:高中化学 来源:2017届河北省高三上第一次月考化学试卷(解析版) 题型:推断题
某无色溶液中可能含有Na+、SO42―、MnO4―、SO32―、Cl―、Br―、CO32―中的若干种,依次进行下列实验。观察到现象如下:
①向溶液中滴加过量氯水,无气体产生,再加入CCl4振荡、静置、CCl4层呈橙色,用分液漏斗分液;
②向分液后的水溶液中加入AgNO3和HNO3的混合液,有白色沉淀产生;
③另取原溶液少量加入BaCl2和盐酸的混合液,无白色沉淀产生。
回答下列问题:
(1)原溶液中肯定含有的离子是 ;肯定没有的离子是 。
(2)②生成的白色沉淀中肯定有_____________(写沉淀的化学式)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二上开学测化学试卷(解析版) 题型:选择题
某反应由两步反应A B
B C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述正确的是
C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述正确的是

A.两步反应均为吸热反应
B.三种化合物中C最稳定
C.加入催化剂会改变反应的能量变化
D.整个反应中能量变化:ΔH=E1-E4
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一上8月摸底化学试卷(解析版) 题型:实验题
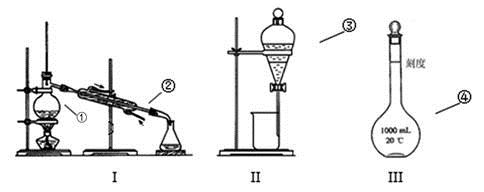
① ;② ;③ ;④ ;(填仪器序号)
(2)分离碘水中的碘应先选择装置 (填名称)
(3)现欲用98%的浓硫酸(密度为1.84g/cm3)配制成浓度为0.5 mol/L的稀硫酸100mL。
①所需仪器除烧杯、玻璃棒外还需 __________、 __________、 __________。
②所取浓硫酸的体积为____________mL。
③下列操作引起所配溶液浓度偏高的是
A.取浓硫酸时俯视
B.将浓硫酸倒出后,洗涤装置,并将洗涤液倒入烧杯中
C.在烧杯中稀释浓硫酸后,立即转移
D定容时俯视
E颠倒摇匀后发现液面低于刻度线,但未加水至刻度线
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一上8月摸底化学试卷(解析版) 题型:选择题
将10g碳酸钙固体高温煅烧一段时间,冷却后投入足量的稀盐酸中完全反应。有关结论错误的是( )
A.共生成0.1mol氧化钙
B.煅烧越充分则消耗的盐酸越少
C.共生成0.1mol二氧化碳
D.煅烧后固体中氧元素的质量分数减小
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一上8月摸底化学试卷(解析版) 题型:选择题
下列实验操作能达到实验目的的是( )
选项[ | 实验目的 | 实验操作 |
A | 除去CO2中少量的CO | 点燃 |
B | 除去CuSO4溶液中的少量FeSO4 | 加入足量的铜粉 |
C | 鉴别澄清石灰水和NaOH溶液 | 加入稀盐酸 |
D | 鉴别硬水和软水 | 加入肥皂水 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上开学测化学试卷(解析版) 题型:推断题
很多鲜花和水果的香味都来自酯的混合物。下图是乙烯等为原料制取乙酸乙酯的过程(部分产物和反应条件已略去)。

请回答下列问题:
(1)B的结构简式为 。
(2)乙烯与水反应生成A的反应类型为 。
(3)A与C反应生成乙酸乙酯的化学方程式为 ,其反应类型为 。
(4)实验室可用右图装置制取乙酸乙酯。
①在试管a中加好相 关试剂后,还需要加入2—3块的碎瓷片,其作用是 。
关试剂后,还需要加入2—3块的碎瓷片,其作用是 。
②试管b中盛有饱和碳酸钠溶液,生成的乙酸乙酯在该溶液的 (填“上”或“下”)层,用分液的方法分离出该产品所需的主要仪器是 。试管b中的导管口应在液面上方而不伸入到液面以下,其原因是 。

查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上开学测化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A. 放热反应在常温下一定是很容易发生
放热反应在常温下一定是很容易发生
B.需要加热才能发生的反应一定是吸热反应
C.在稀溶液中,1 mol酸与1mol碱发生中和反应时所释放的热量叫中和热
D.一个反应是放热还是吸热,主要取决于反应物总能量与生成物总能量的相对大小
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高二上开学测化学试卷(解析版) 题型:填空题
在一体积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生如下反应:CO(g) + H2O(g)  CO2(g) + H2(g)△H<0。CO和H2O(g)浓度变化如右图
CO2(g) + H2(g)△H<0。CO和H2O(g)浓度变化如右图
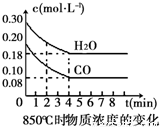
(1)0~4min的平均反应速率v(CO)=___________mol•L-1•min-1.
(2)该条件下,此反应的平衡常数K=___________(写表达式).
(3)该反应平衡时CO的转化率为________________。
(4)能判断该反应达到化学平衡状态的依据是______________。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v(H2)正=v(H2O)逆 D.c(CO2)=c(CO)
(5)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表.

① c1数值___________0.08mol•L-1(填大于、小于或等于).
②反应在4min~5min间,平衡向逆方向移动,可能的原因是________________,表中5min~6min之间数值发生变化,可能的原因是_______________。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com