
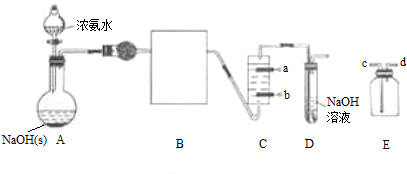
分析 (1)B中盛装是净化碱性气体氨气中的水,所以选用的试剂是碱石灰或者生石灰;
(2)装置E用收集气体时,如气体的密度比空气小用向上排空法,即d进c出;
(3)b极应产生氯气与a极产生的氢氧化钠充分接触生成次氯酸钠;
(4)氨气与次氯酸钠发生氧化还原反应生成一氯胺,反应的方程式为:NaClO+NH3=NH2Cl+NaOH;
(5)淀粉遇碘变蓝色,可用淀粉作指示剂,滴定终点时,溶液蓝色变为无色;
(6)由方程式:NH2Cl+3I-+2H2O═NH3•H2O+OH-+Cl-+I3-;I3-≒I2+I-;I2+2S2O32-═2I-+S4O62-;可得到关系式:NH2Cl~I3-~I2~2S2O32-进行计算.
解答 解:(1)B中盛装是净化碱性气体氨气中的水,所以选用的试剂是碱石灰或者生石灰,故答案为:碱石灰或者生石灰;
(2)E置于B、C之间,可用于收集制备未完全反应的氨气,收集时,应d进c出,故答案为:d;
(3)b极应产生氯气与a极产生的氢氧化钠充分接触生成次氯酸钠,氯由-1价变成0价的氯,化合价升高发生氧化反应,所以b是阳极,与电源的正极相连,故答案为;正;
(4)氨气与次氯酸钠发生氧化还原反应生成一氯胺,反应的方程式为:NaClO+NH3=NH2Cl+NaOH,故答案为:NaClO+NH3=NH2Cl+NaOH;
(5)淀粉遇碘变蓝色,可用淀粉作指示剂,滴定终点时,溶液蓝色变为无色,所以滴定时选用的指示剂是:淀粉溶液,故答案为:淀粉;
(6)由方程式:NH2Cl+3I-+2H2O═NH3•H2O+OH-+Cl-+I3-;I3-≒I2+I-;I2+2S2O32-═2I-+S4O62-;可得到关系式:
NH2Cl~I3-~I2 ~2S2O32-;
1 2
C×20×10-3L 0.100mol/L×5×10-3L
解之得:C=$\frac{0.100mol/L×5×1{0}^{-3}L}{2×20×1{0}^{-3}L\\;\\;\\;\\;\\;}$=0.0125mol/L,故答案为:0.0125mol/L.
点评 本题是一道综合考查题,有关于制备液体火箭燃料偏二甲肼的制备的题目和氧化还原反应滴定的计算,难度中等,注意利用关系式计算.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 用稀盐酸洗涤盛放过石灰水的试剂瓶 | |
| B. | 配制FeCl3溶液时,向溶液中加入少量Fe和稀盐酸 | |
| C. | 用待测液润洗滴定用的锥形瓶 | |
| D. | Na2CO3溶液保存在带玻璃塞的试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取1.06 g 无水碳酸钠,加入100ml容量瓶中,加水溶解、定容 | |
| B. | 称取1.06 g 无水碳酸钠,加入100ml蒸馏水,搅拌、溶解 | |
| C. | 转移Na2CO3溶液时,未用玻璃棒个引流,直接倒入容量瓶中 | |
| D. | 定容后,塞好瓶塞,反复倒转,摇匀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu与FeCl3溶液反应:Cu+2Fe3+═2Fe2++Cu2+ | |
| B. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 向AlCl3溶液中滴入过量NaOH溶液:Al3++3OH-═Al(OH)3↓ | |
| D. | Na与水反应:Na+2H2O═Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气是一种有强烈刺激气味的气体 | |
| B. | 氨气能被氧化为NO,是工业生产硝酸的重要原料之一 | |
| C. | 铵盐易和碱反应生成具有挥发性的氨气,在实验室中用NH4Cl和Ca(OH)2的混合物制取氨气 | |
| D. | 氨气极易溶于水,可用作制冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有电子转移是氧化还原反应的本质,有元素化合价的变化是氧化还原反应的外观表现 | |
| B. | 一种物质被氧化,必然有另一种物质被还原 | |
| C. | 被氧化的物质得到或偏向电子,被还原的物质失去或偏离电子 | |
| D. | 氧化剂在反应中被氧化,还原剂在反应中被还原 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com