
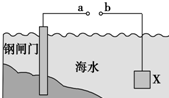
| A. | 当a、b间用导体连接时,则X应发生氧化反应 | |
| B. | 当a、b间用导体连接时,则X可以是锌或石墨 | |
| C. | 当a、b与外接电源相连时,a应连接电源的正极 | |
| D. | 当a、b与外接电源相连时,阴极的电极反应式:2Cl--2e→Cl2↑ |
分析 A.牺牲阳极的阴极保护法中,被保护的金属作原电池正极,则X为负极发生氧化反应;
B.牺牲阳极的阴极保护法中,被保护的金属作原电池正极,则X为负极,其活泼性大于铁;
C.外加电流的阴极保护法中,被保护的金属作阴极应于电源负极相连;
D.外加电流的阴极保护法中,被保护的金属作阴极发生还原反应.
解答 解:A.牺牲阳极的阴极保护法中,被保护的金属作原电池正极,如果a、b间用导线连接形成原电池,则X作负极发生氧化反应,钢质闸门为正极,故A正确;
B.牺牲阳极的阴极保护法中,被保护的金属作原电池正极,如果a、b间用导线连接形成原电池,则X作负极,其活泼性大于铁,则X可以是锌但不能为石墨,故B错误;
C.外加电流的阴极保护法中,被保护的金属作阴极应于电源负极相连,所以当a、b与外接电源相连时形成电解池,钢质闸门应于电源负极相连作阴极,所以a应连接电源的负极,故C错误;
D.外加电流的阴极保护法中,被保护的金属作阴极发生还原反应,所以当a、b与外接电源相连时,阴极的电极反应式2H++2e-═H2↑,故D错误;
故选A.
点评 本题考查了原电池和电解池原理,涉及金属的腐蚀与防护,明确哪种电极被保护、哪种电极被腐蚀是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Tl+的最外层有1个电子 | B. | Tl能形成+3价和+1价的化合物 | ||
| C. | 酸性溶液中Tl3+比Tl+氧化性强 | D. | Tl+的还原性比Ag弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 残留固体是2mol Na2CO3 | |
| B. | 残留固体是 Na2CO3和NaOH的混合物 | |
| C. | 反应中转移2mol电子 | |
| D. | 排出的气体是1.5mol氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚丙烯的链节:-CH2-CH2-CH2- | B. | 二氧化碳分子的比例模型: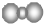 | ||
| C. | 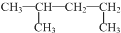 的名称:1,3-二甲基丁烷 的名称:1,3-二甲基丁烷 | D. | 氯离子的结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
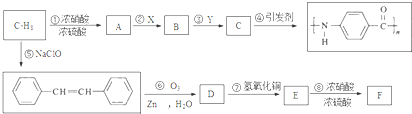
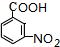 .A~E中互为同分异构体的还有
.A~E中互为同分异构体的还有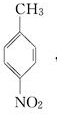 和
和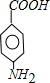 .(填结构简式)
.(填结构简式)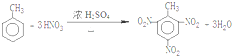 .
.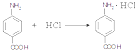 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H、D、T互为同位素 | |
| B. | NaHCO3、HCOONa均含有离子键和共价键 | |
| C. | 常温常压下,22.4 L CCl4含有NA个CCl4分子 | |
| D. | 常温下,23 g NO2含有NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com