
 25℃时,电离平衡常数:CH3COOH:1.8×10-5 H2CO3::K1 4.3×10-7
25℃时,电离平衡常数:CH3COOH:1.8×10-5 H2CO3::K1 4.3×10-7分析 (1)对应酸的酸性越弱,其盐的水解程度越大,溶液的碱性越强,溶液pH越大;当pH相同时,酸越强,盐的浓度越大;
(2)CH3COOH溶液加水稀释过程,促进电离,由于溶液的体积增大,所以c(H+)减小,Kw不变,则c(OH-)增大,温度不变平衡常数不变,据此分析;
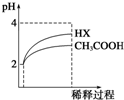
(3)由图可知,稀释相同的倍数,HX的pH变化程度大,则酸性HX强,电离平衡常数大,稀释100倍溶液PH增大小于4,说明HX为弱酸;
(4)25℃时,混合液pH=6,c(H+)=1.0×10-6mol/L,则由Kw可知,c(OH-)=1.0×10-8mol/L,由电荷守恒可知,c(CH3COO-)-c(Na+)=c(H+)-c(OH-).
解答 解:(1)在相同的条件下测得a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3,溶液浓度相同,已知酸性:CH3COOH>H2CO3>HClO>HCO3-,所以水解程度:a.Na2CO3>b.NaClO>d.NaHCO3>c.CH3COONa,pH由大到小的顺序是a,b,d,c,
故答案为:a>b>d>c;
(2)A.CH3COOH溶液加水稀释过程,促进电离,由于溶液的体积增大的程度大,所以c(H+)减小,氢离子物质的量增大,故A选;
B. $\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{n({H}^{+})}{n(C{H}_{3}COOH)}$,CH3COOH溶液加水稀释过程,促进电离,氢离子物质的量增大,醋酸物质的量减小,则稀释过程中比值变大,故B选;
C.稀释过程,c(H+)减小,c(OH-)增大,c(H+)•c(OH-)=Kw,Kw只受温度影响所以不变,故C不选;
D.常温下0.1mol•L-1的CH3COOH溶液加水稀释过程中,氢离子浓度减小,溶液中离子积常数不变,氢氧根离子浓度增大,故D选;
E.电离平衡常数随温度变化,温度不变Ka不变,故E不选;
故答案为:ABD;
(3)由图可知,稀释相同的倍数,HX的pH变化程度大,则酸性HX强,电离平衡常数大,则HX的电离平衡常数大于醋酸的电离平衡常数,图象可知HX稀释100倍溶液PH小于4,说明HX为弱酸,电离方程式为HX?X-+H+,稀释后,HX溶液中氢离子浓度小,醋酸溶液中氢离子浓度大,若加同样的金属锌片,开始反应速率较快的是醋酸,
故答案为:大于;HX?X-+H+;醋酸;
(4)25℃时,混合液pH=6,c(H+)=1.0×10-6mol/L,则由Kw可知,c(OH-)=1.0×10-8mol/L,由电荷守恒可知,c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=1.0×10-6-1.0×10-8mol/L=9.9×10-7 mol•L-1,
故答案为:9.9×10-7 mol•L-1.
点评 本题考查了弱电解质电离平衡的影响因素、水的电离、溶液稀释、盐类水解等知识点,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:实验题

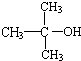 结构相似的醇不能被氧化为醛或酸.
结构相似的醇不能被氧化为醛或酸.
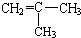 .
.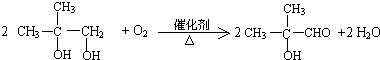 .
.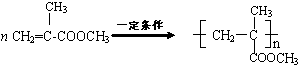 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2OCH3 | B. | CH3CH(OH)CH3 | C. | CH3CH2COOH | D. | CH3CH2CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸和乙醇的酯化反应 | |
| B. | 乙醇与Na反应 | |
| C. | 乙醇与氧气在Cu作催化剂条件下反应 | |
| D. | 在镍作催化剂的条件下,苯与氢气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 | |
| B. | 电解饱和AlCl3饱和溶液,可制得金属铝 | |
| C. | 明矾溶于水形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| D. | FeCl3溶液可用于刻制印刷铜电路板 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “水乳交融,火上浇油”前者包含物理变化,而后者包含化学变化 | |
| B. | “曾青得铁化为铜”发生了化学变化 | |
| C. | “滴水石穿、绳锯木断”不包含化学变化 | |
| D. | “卤水点豆腐,一物降一物”的前半句话与胶体知识有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | VIIA | 0 | |
| 1 | ① | |||||||
| 2 | ③ | ④ | ⑧ | |||||
| 3 | ② | ⑤ | ⑥ | |||||
| 4 | ⑦ |

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非自发反应就是不可能发生的反应,自发反应就是能较快进行的反应 | |
| B. | 高温高压下可以使石墨转化为金刚石是自发的化学反应 | |
| C. | 由能量判据和熵判据组合而成的复合判据,将更适合于所有的过程 | |
| D. | 反应NH3(g)+HCl(g)═NH4Cl(s)在低温下能自发进行,说明该反应的△H>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com