
铁及其化合物与生产、生活关系密切.
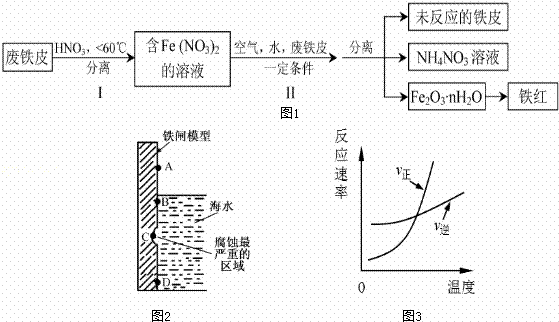
(1)如图2是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图这一腐蚀过程中发生还原反应的物质是 (填化学式).图2中A、B、C、D四个区域,生成铁锈最多的是 (填字母).
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:(图1)
步骤 I若温度过高,将不利于反应的进行,用适当的文字和化学方程式进行解释: .
步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O→2Fe2O3•nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为 上述生产流程中,能体现“绿色化学”思想的是 (任写一项).
(3)已知t℃时,反应FeO(s)+CO(g)⇌Fe(s)+CO2(g)的平衡常数为K1.写出K1的表达式 .若该反应在恒容容器中反应时满足图3所示变化,则该反应的正反应为 反应(选填“吸热”或“放热”).若在t℃的2L恒温密闭容器中加入0.02mol FeO(s),并通入一定量CO.若5min后FeO(s)转化率为50%,则CO2的平均反应速率为 .
| 金属的回收与环境、资源保护;化学平衡建立的过程. | |
| 专题: | 化学平衡专题;元素及其化合物. |
| 分析: | (1)①由图可知,海水溶液为弱酸性,发生吸氧腐蚀,氧气具有强氧化性,充当氧化剂,被还原; ②A发生化学腐蚀,B发生电化学腐蚀,C已经腐蚀后有氧化层,D在金属内部; (2)由流程图可知,Fe与硝酸反应生成硝酸亚铁,步骤Ⅱ中转化为Fe2O3•nH2O,最后得到铁红, 硝酸分解生成二氧化氮、氧气、水;产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,则Fe与硝酸反应生成硝酸亚铁、硝酸铵和水;氮氧化物为有毒气体; (3)K= 通入x mol CO,t℃时反应达到平衡.此时FeO(s)转化率为50%,即反应的FeO为0.02mol×50%=0.01mol,则 FeO(s)+CO(g)⇌Fe(s)+CO2(g) 开始 0.02 x 0 0 转化 0.01 0.01 0.01 0.01 平衡 x﹣0.01 0.01 结合化学反应速率计算. |
| 解答: | 解:(1)由图可知,海水溶液为弱酸性,则Fe失去电子,正极上O2得到电子,发生吸氧腐蚀,A发生化学腐蚀,B发生电化学腐蚀,C已经腐蚀后有氧化层,D在金属内部,显然B中腐蚀速率最快,生成铁锈最多,故答案为:O2;B; (2)由流程图可知,Fe与硝酸反应生成硝酸亚铁,步骤Ⅱ中转化为Fe2O3•nH2O,最后得到铁红;硝酸分解生成二氧化氮、氧气、水,该反应为4HNO3 故答案为:4HNO3 (3)依据化学反应方程式得出:平衡常数K= t℃时反应达到平衡.此时FeO(s)转化率为50%,即反应的FeO为0.02mol×50%=0.01mol,则 FeO(s)+CO(g)⇌Fe(s)+CO2(g) 开始 0.02 0 转化 0.01 0.01 平衡 0.01 故v(CO2)= |
| 点评: | 本题考查较综合,涉及化学平衡计算、电化学腐蚀及物质的制备流程等,为高频考点,侧重分析能力及计算能力的考查,把握化学反应原理及图象、流程的分析为解答的关键,题目难度中等. |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
化学与社会、生活密切相关,下列说法正确的是( )
A. 纳米材料直径一般在几纳米到几十纳米(1nm=10﹣9m)之间,因此纳米材料属于胶体
B. 青铜是我国使用最早的合金
C. SiO2制成的玻璃纤维,由于导电能力强而被用于制造通讯光缆
D. 明矾与漂白粉都是水处理药品,原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
氨、甲烷都是重要的氢化物,按要求回答下列问题:
(1)NH3(g)和O2(g)反应生成NO(g)和H2O(g)的△H往往难以直接测量,从产物稳定性看,其主要原因是 .
已知:1molN2(g)反应生成2mol NH3(g)的△H=﹣92kJ•mol﹣1,1mol H2(g)燃烧生成H2O (g) 的△H=﹣242kJ•mol﹣1,1mol N2(g)和O2 (g)完全反应生成NO(g)的△H=+180kJ•mol﹣1.若有17g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为 .
(2)甲烷与水蒸气通入聚焦太阳能反应器,可发生反应的化学方程式为CH4+H2O⇌CO+3H2,该反应为吸热反应.已知在三种不同条件(Ⅰ、Ⅱ、Ⅲ)下,氢气的产量随时间的变化如图1所示.
①在0~20小时内,甲烷的反应速率vⅠ、vⅡ和vⅢ从大到小的顺序为 .
②将0.4mol甲烷和0.4mol水蒸气充入2L恒容的密闭容器中,某条件下反应达到平衡,测得氢气的物质的量浓度为0.3mol•L﹣1,则该条件下此反应的平衡常数K= ,甲烷的转化率为 .
③氢气的百分含量与体系总压强(P)、温度(T)的关系如图2所示.
平衡状态由A变到B时,对应的平衡常数:K(A) K(B)(填“>”、“<”或“=”).
查看答案和解析>>
科目:高中化学 来源: 题型:
卤素单质及化合物在许多性质上都存在着递变规律.下列有关说法正确的是( )
|
| A. | 卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深 |
|
| B. | 卤化氢的键长按H﹣F、H﹣C1、H﹣Br、H﹣I的顺序依次减小 |
|
| C. | 卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱 |
|
| D. | 卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易 |
查看答案和解析>>
科目:高中化学 来源: 题型:
碳纳米管是近年来材料科学研究的热点.为除去碳纳米管中的杂质﹣﹣碳纳米颗粒(少量碳原子的聚集体),可以将样品溶解于强酸性的K2Cr2O7溶液中充分反应,当溶液由橙色转变为墨绿色(Cr3+)即可,同时放出一种无毒的气体.以下判断正确的是( )
|
| A. | 可以用浓盐酸调节K2Cr2O7溶液的酸性 |
|
| B. | 该过程中每氧化2 mol碳纳米颗粒,转移8NA个电子 |
|
| C. | 若将该反应设计为原电池,则碳纳米颗粒应作为原电池的正极 |
|
| D. | 可以通过过滤的方法最终得到碳纳米管 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:4NH3+5O2 4NO+6H2O,4NO+3O2+2H2O→4HNO3
4NO+6H2O,4NO+3O2+2H2O→4HNO3
设空气中氧气的体积分数为0.20,氮气的体积分数为0.80.
(1)a mol NO完全转化为HNO3理论上需要氧气 mol.
(2)为使NH3恰好完全氧化为NO,氨﹣空气混合气体中氨的体积分数(用小数表示)为 (保留2位小数).
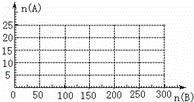
(3)20.0mol NH3用空气氧化,产生混合物的组成为:NO 18.0mol、O2 12.0mol、N2 150.0mol和一定量硝酸,以及其他成分(高温下NO与O2不化合).计算氨转化为NO和HNO3的总转化率.
(4)20.0mol NH3和一定量空气充分反应后,再转化为硝酸.通过计算,在图中画出HNO3的物质的量n(A)和空气的物质的量n(B)关系的理论曲线.
查看答案和解析>>
科目:高中化学 来源: 题型:
以2010年诺贝尔化学奖获得者的名字命名的赫克反应、根岸反应和铃木反应已成为化学家们制造复杂化学分子的“精致工具”,在科研、医药和电子等领域已经广泛应用。下例生成物就是由铃木反应合成出来的一种联苯的衍生物:( )

下列叙述正确的是 ( )
A.该反应为加成反应,且原子利用率达100%
B.该联苯的衍生物属于芳香烃
C.该联苯的衍生物苯环上的一硝基取代产物有5种
D.该联苯的衍生物不可使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
乙烯酮(CH2=C=O)在一定条件下能与含活泼氢的化合物发生加成反应,反应可表示为:CH2=C=O+HA→CH3—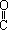 A。乙烯酮在一定条件下可与下列试剂加成,其产物不正确的是( )
A。乙烯酮在一定条件下可与下列试剂加成,其产物不正确的是( )
A 与HCl加成生成CH3COCl
B 与H2O加成生成CH3COOH
C 与CH3OH加成生成CH3COCH2OH
D 与CH3COOH加成生成CH3—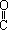 -O—
-O—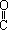 -CH3
-CH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com