
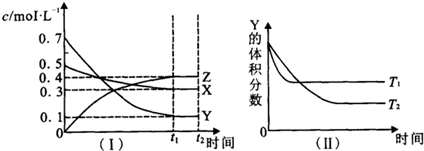
| A、图(Ⅱ)中T1>T2,则正反应是吸热反应 |
| B、t2 min时,保持压强不变,通入稀有气体,平衡向正反应方向移动 |
| C、其它条件不变,升高温度,正、逆反应速率均增大,且X的转化率增大 |
| D、T℃时,若密闭容器中各物质起始浓度为:0.4mol?L-1 X、0.4mol?L-1 Y、0.2mol/L Z保持其他条件不变,达到平衡时z的浓度为0.4 mol?L-1 |
 2Z(g),
2Z(g), ?2Z(g),
?2Z(g),| (0.4)2 |
| 0.3×(0.1)3 |
| 1600 |
| 3 |
 ?2Z(g)
?2Z(g)| (0.4)2 |
| 0.3×(0.1)3 |
| 1600 |
| 3 |


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
| A、燃煤中加入适量石灰石可以减少SO2的排放 |
| B、淀粉和纤维素互为同分异构体 |
| C、酚醛塑料具有热固性,可做烹饪器材的手柄 |
| D、橡胶硫化可以提高橡胶的强度和韧性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝是地壳中含量最多的金属元素 |
| B、地球上的金属元素都是以化合态形式存在于自然界中 |
| C、所有金属都具有导电导热性,且在常温下都是固体 |
| D、金刚石是一种以金为主而构成的合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 |
| B、将纯水加热至较高温度,水的离子积变大、pH变小、呈中性 |
| C、N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大 |
| D、水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 充电 |
| 放电 |
| A、Cd |
| B、NiO(OH) |
| C、Cd(OH)2 |
| D、Ni(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3COONa浓溶液 |
| B、NH3?H2O |
| C、浓盐酸 |
| D、H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 操作 | 现象 | 结论 |
| A | 常温下将铁片分别放在浓硝酸和稀硝酸中 | 在浓硝酸中无明显变化,稀硝酸中有气泡 | 稀硝酸的氧化性比浓硝酸强 |
| B | 将一小块Na放入无水乙醇中 | 产生气泡 | Na能置换出醇羟基中的氢 |
| C | 将水蒸气通过灼热的铁粉 | 铁粉变成红棕色粉末 | 铁与水在高温下发生反应 |
| D | 常温下将Al片放入浓硫酸中 | 无明显变化 | Al与浓硫酸不反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com