
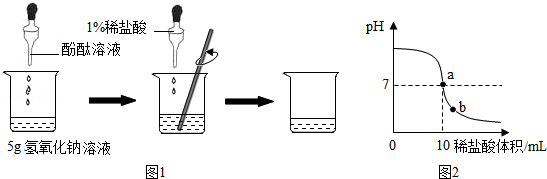
分析 (1)①根据酚酞遇碱性溶液变红,可以用来检验酸碱是否发生中和反应;
②根据盐酸与氢氧化钠反应分析回答;
③根据氢氧化钠与盐酸的反应,由盐酸溶质的质量求出氢氧化钠的质量,再求出氢氧化钠溶液中溶质的质量分数;
(2)①根据pH试纸使用方法分析判断;
②根据溶液pH的变化图象的意义,分析a的含义、b点溶液中的阳离子;由盐酸的体积和密度可求出盐酸的质量;
(3)根据氢氧化钠与二氧化碳的反应写出氢氧化钠变质的方程式,根据碳酸钠的性质分析设计除去碳酸钠的实验方案.
解答 解:(1)①酚酞遇碱性溶液变红,酚酞溶液的作用是:判断反应是否恰好完成,
故答案为:判断反应是否恰好完成;
②在中和反应过程中,边滴加稀盐酸,随着氢氧化钠逐渐减少至消失,溶液由红色液体变成无色,
故答案为:溶液由红色液体变成无色;
③盐酸中溶质的质量为:7.3g×1%=0.073g
设氢氧化钠的质量为x
NaOH+HCl=NaCl+H2O
40 36.5
x 0.073g
得:x=0.08g
甲组这瓶氢氧化钠溶液中溶质的质量分数为:$\frac{0.08g}{5g}$×100%=1.6%,
故答案为:1.6%;
(2)①A.将pH试纸剪成几段节约使用,方法正确;
B.将pH试纸直接插入待测液中,会污染试剂,方法错误;
C.将pH试纸放在干净的白瓷板上,用玻璃棒蘸取待测液滴在pH试纸上,方法正确;
D.将pH试纸润湿后,测得碱液的pH偏小,方法错误;
故答案为:AC;
②由溶液pH的变化图象可知,在a点时,溶液的pH等于7,说明了氢氧化钠和盐酸恰好中和;在b点时,溶液呈酸性,氢氧化钠全部与盐酸反应生成了氯化钠,溶液中还有剩余的盐酸.所以溶液中的阳离子是:Na+、H+;要求氢氧化钠溶液的质量质量分数,须知盐酸的质量,由题中的条件可知,还需要的数据是稀盐酸的密度.
故答案为:恰好中和或恰好完全反应;Na+、H+;稀盐酸的密度;
(3)氢氧化钠变质的原因是氢氧化钠与空气中的二氧化碳反应,反应的方程式是:CO2+2NaOH=Na2CO3+H2O.由于碳酸钠能与氢氧化钙反应生成了氢氧化钠和碳酸钙,既除去了杂质碳酸钠,又没有引入新的杂质.所以,要除去溶液中变质生成的杂质,实验方案是:加适量澄清石灰水,过滤.
故答案为:CO2+2NaOH═Na2CO3+H2O; 加适量澄清石灰水(或氢氧化钡溶液),过滤.
点评 本题是考查中和反应过程中溶液pH的变化情况的,我们要知道向酸中加碱和向碱中加酸时,溶液pH的变化趋向.明确不同指示剂的变色范围,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 氯气通入水中 Cl2+H2O?H++Cl-+HClO | |
| B. | 甲烷的完全燃烧CH4(g)+2O2(g)$\frac{\underline{\;点燃\;}}{\;}$ CO2(g)+2H2O(l)△H<0 | |
| C. | 冰醋酸加入水中CH3COOH+H2O?CH3COO-+H3O+ | |
| D. | 铁与水蒸气反应 2Fe+3H2O$\frac{\underline{\;高温\;}}{\;}$ Fe2O3+3H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,0.1 mol碳酸钠晶体中含有CO32-的个数为0.1NA | |
| B. | 标准状况下22.4 L H2O所含分子数为NA | |
| C. | 1 L 0.5 mol•L-1 CH3COOH溶液中,CH3COO-的个数为0.5NA | |
| D. | 在NO、NO2的混合气体22.4 L中,含有的氮原子数为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
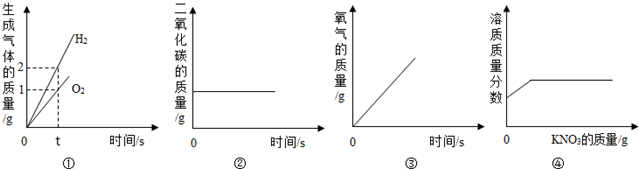
| A. | ①水的电解 | |
| B. | ②木炭在密闭的容器内燃烧 | |
| C. | ③加热一定量的高锰酸钾制氧气 | |
| D. | ④20℃时,向一定量接近饱和的硝酸钾溶液中加入硝酸钾固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
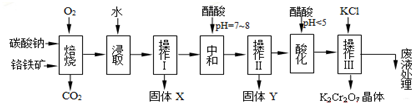
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度 (g/100g水) | 0℃ | 28 | 35.7 | 4.7 | 163 |
| 40℃ | 40.1 | 36.4 | 26.3 | 215 | |
| 80℃ | 51.3 | 38 | 73 | 376 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
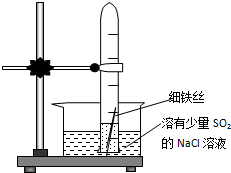 有一研究性学习小组在探究有关钢铁的腐蚀情况,他们进行了如下实验:在一个水槽中盛装1000mL水,加入一定量的NaCl固体溶解后通入SO2气体至溶液pH值约为4左右,另取一支试管(带刻度,规格50mL),一条约5cm 的细铁丝,将铁丝放入试管中,加入约10mL前面配好的溶液,迅速用拇指扣住试管口倒扣于水槽中,用铁架台将试管固定,如图.过一会儿:
有一研究性学习小组在探究有关钢铁的腐蚀情况,他们进行了如下实验:在一个水槽中盛装1000mL水,加入一定量的NaCl固体溶解后通入SO2气体至溶液pH值约为4左右,另取一支试管(带刻度,规格50mL),一条约5cm 的细铁丝,将铁丝放入试管中,加入约10mL前面配好的溶液,迅速用拇指扣住试管口倒扣于水槽中,用铁架台将试管固定,如图.过一会儿:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com