
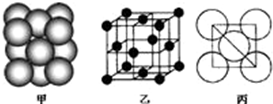
 ①若某金属M为第四周期单电子数最多的元素,该元素在周期表中的位置
①若某金属M为第四周期单电子数最多的元素,该元素在周期表中的位置| 1 |
| 2 |
| 1 |
| 2 |
| 0.0030 |
| 0.0015 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、滴入盐酸,先产生沉淀,然后沉淀又溶解 |
| B、都能透过半透膜 |
| C、都有丁达尔现象 |
| D、都是均一的分散系 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 实验内容 | 实验结果 |
| ① | 第一份中加AgNO3溶液 | 有白色沉淀生成 |
| ② | 第二份中加足量NaOH溶液并加热 | 只收集到标准状况下0.896L气体,无沉淀生成,同时得到溶液A |
| ③ | 向溶液A中通入过量CO2,所得白色沉淀经过滤、洗涤、灼烧后称量 | 固体质量为2.04g |
| ④ | 第三份加足量BaCl2溶液,所得沉淀经足量稀盐酸洗涤、干燥后称量 | 沉淀质量为23.3g |
| 阴离子符号 | 物质的量浓度(mol?L-1) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图中A、B、C、D、E均为有机化合物.已知:C能跟NaHCO3溶液发生反应,C和D的相对分子质量相等,且E为无支链的化合物.请回答下列问题:
如图中A、B、C、D、E均为有机化合物.已知:C能跟NaHCO3溶液发生反应,C和D的相对分子质量相等,且E为无支链的化合物.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 1.NaOH溶液 |
| 2.稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al2O3既能溶于NaOH溶液又能溶于HCl,说明Al2O3是两性氧化物 |
| B、浓硫酸能干燥SO2、NO2等气体,说明浓硫酸具有吸水性 |
| C、SO2气体具有漂白性,通入紫色石蕊溶液中能使溶液先变红后褪色 |
| D、石英的主要成分是SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若A、B为同一周期元素,则AB3分子一定为平面正三角形 |
| B、若AB3分子中的价电子个数为24个,则AB3分子为平面正三角形 |
| C、若为A、B为同一主族元素,则AB3分子一定为三角锥形 |
| D、若AB3分子为三角锥形,则AB3分子一定为NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 科学家合成了一系列独特的氢铝化合物.最简单的氢铝化合物化学式为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法不正确的是( )
科学家合成了一系列独特的氢铝化合物.最简单的氢铝化合物化学式为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法不正确的是( )| A、Al2H6中Al为-3价,H为+l价 |
| B、Al2H6在空气中完全燃烧,产物为氧化铝和水 |
| C、Al2H6是共价化合物 |
| D、氢铝化合物可能成为未来的储氢材料和火箭燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3CHOHCHOHCH3 |
| B、HOCH2CHOHCH3 |
| C、CH3CH2CH2OH |
| D、CH3CHOHCH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com