
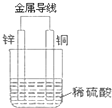
 (1)现有如下两个反应:①NaOH+HCl═NaCl+H2O;②Fe+H2SO4═FeSO4+H2↑
(1)现有如下两个反应:①NaOH+HCl═NaCl+H2O;②Fe+H2SO4═FeSO4+H2↑分析 (1)酸碱中和反应和活泼金属与酸的反应都是放热反应;要构成原电池必须能自发的氧化还原反应;
(2)①原电池中电子从活泼的负极沿导线流向正极;阳离子向正极移动;
②铜是正极,发生还原反应,电极反应式为:2H++2e-=H2↑;
③负极发生氧化反应,电极反应式为:Zn-2e-═Zn2+;
④电路中移转2mol的电子生成的氢气在标准状况下的体积为22.4L,以此分析解答;
(3)电解氯化铜溶液时,阴极上是铜离子得电子的还原反应.
解答 解:(1)酸碱中和反应和活泼金属与酸的反应都是放热反应,所以①②都是放热反应;要构成原电池必须能自发的氧化还原反应,NaOH+HCl=NaCl+H2O是非氧化还原反应,而Fe+H2SO4=FeSO4+H2↑是氧化还原反应,故答案为:①②;②;
(2)由图锌是负极,负极发生氧化反应,电极反应式为:Zn-2e-═Zn2+;铜是正极,发生还原反应,电极反应式为:2H++2e-=H2↑,
①电子从锌Zn片流出,溶液中H+向铜,故答案为:Zn;Cu;
②铜是正极,发生还原反应,电极反应式为:2H++2e-=H2↑,所以现象有气泡产生,故答案为:有气泡产生;还原;
③负极发生氧化反应,电极反应式为:Zn-2e-═Zn2+,故答案为:Zn-2e-═Zn2+;
④电路中移转2mol的电子生成的氢气在标准状况下的体积为22.4L,所以有0.01mol电子发生转移,生成标况的体积为0.112L,故答案为:0.112;
(3)电解氯化铜溶液时,阴极上是铜离子得电子的还原反应,即Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu.
点评 本题考查原电池原理,侧重考查电极反应式书写、电子流向及阴阳离子移动方向等知识点,电解质溶液中阴阳离子移动方向是学习难点,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
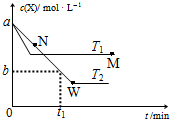 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )| A. | M点的正反应速率v正小于N点的逆反应速率v逆 | |
| B. | T2下,在0~t1时间内,v(Y)=$\frac{a-b}{{t}_{1}}$mol•L--1•min--1 | |
| C. | M点时再加入一定量X,平衡后X的转化率减小 | |
| D. | 该反应进行到M点放出的热量小于进行到W点放出的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 H2O和CS2分子中的原子都达到了稳定结构.
H2O和CS2分子中的原子都达到了稳定结构.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
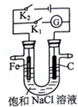
| A. | K1闭合,电流方向由铁棒经导线流向石墨棒 | |
| B. | K1闭合,向铁棒附近滴入K3[Fe(CN)6]溶液,有蓝色沉淀出现 | |
| C. | K2闭合,碳棒是阴极 | |
| D. | K2闭合,电路中通过0.2NA个电子时,两极共产生4.48 L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(SO42-)为0.1mol/L | B. | 100mL溶液中含0.01mol CO32- | ||
| C. | K+可能存在 | D. | Ba2+一定不存在,Ca2+可能存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能够完全电离的电解质称为强电解质,如硫酸、盐酸、氢氧化钠等是强电解质 | |
| B. | 1mol甲烷燃烧放出的热量为CH4的燃烧热 | |
| C. | 中和反应都有盐和水生成,有盐和水生成的反应都属于中和反应 | |
| D. | 风能是正在探索的新能源之一,它是太阳能的一种转换形式,具有不稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com