
| A. | 某密闭容器中盛有0.2molSO2和0.1molO2,一定条件下充分反应,生成SO3分子数为0.2NA | |
| B. | 一定条件下,2.3gNa与O2完全反应生成3.6g产物时失去的电子数为0.1NA | |
| C. | 25℃时,0.1mol•L-1Na2S溶液中含有Na+的数目为0.2NA | |
| D. | 将1mL5.68mol•L-1的FeCl3饱和溶液制成胶体,可得到0.00568NA个Fe(OH)3胶体 |
分析 A.该反应为可逆反应,反应物不可能完全转化成生成物;
B.钠为+1价金属,根据n=$\frac{m}{M}$计算出钠的物质的量,然后计算出失去电子的物质的量及数目;
C.缺少溶液体积,无法计算溶液中钠离子的数目;
D.氢氧化铁胶粒为氢氧化铁的聚集体,无法计算生成胶粒数目.
解答 解:A.某密闭容器中盛有0.2molSO2和0.1molO2,一定条件下充分反应,由于该反应为可逆反应,则生成三氧化硫的物质的量小于0.2mol,生成SO3分子数小于0.2NA,故A错误;
B.2.3g钠的物质的量为0.1mol,0.1mol钠完全反应一定失去0.1mol电子,失去的电子数为0.1NA,故B正确;
C.没有告诉0.1mol•L-1Na2S溶液的体积,无法计算溶液中含有钠离子的数目,故C错误;
D.Fe(OH)3胶粒为氢氧化铁的聚集体,则无法计算得到氢氧化铁胶粒的数目,故D错误;
故选B
点评 本题考查了阿伏伽德罗常数的综合应用,题目难度不大,明确物质的量与其它物理量之间的关系为解答关键,D为易错点,注意氢氧化铁胶粒为氢氧化铁的聚集体,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
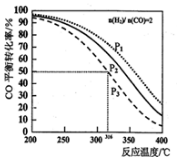
| A. | 上述反应△H<0 | |
| B. | 图中P1<P2<P3 | |
| C. | 若在P3和316℃时,测得容器中n(H2)=n(CH3OCH3),此时v(正)<v(逆) | |
| D. | 若在P3和316℃时,起始时$\frac{n({H}_{2})}{n(CO)}$=3,则达到平衡时,CO转化率小于50% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不溶于水的盐(CaCO3、BaSO4等)都是弱电解质 | |
| B. | 可溶于水的盐都是强电解质 | |
| C. | 电解质溶液导电的原因是溶液中有自由移动的阴阳离子 | |
| D. | 熔融的电解质都能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮及其化合物在工农业生产中具有重要作用.完成下列填空:
氮及其化合物在工农业生产中具有重要作用.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 催化剂 | 是否添加CaO | 还原产物 |
| 1 | Fe3O4 | 添加 | 有Fe |
| 2 | Fe3O4 | 不添加 | 无Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 试验操作 | 现象 | 结论 |
| A | 向浓度为0.1molL-1MgSO4、CuSO4混合溶液中逐滴加入NaOH溶液 | 先看到蓝色沉淀生成 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| B | 测量熔融状态下NaHSO4 | 能导电 | 熔融状态下NaHSO4能电离出Na+、H+、SO42- |
| C | 向某溶液中滴加NaOH溶液并将湿润的红色石蕊试纸置于试管口 | 试纸颜色没变化 | 原溶液中无NH4+ |
| D | 向Fe(NO)2溶液中加入0.1mol•L-1H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO3-被Fe2+ 还原为NO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L水中含有1molH2SO4 | |
| B. | 1L溶液中含有1molH+ | |
| C. | 将98gH2SO4溶于1L水中配成上述溶液 | |
| D. | 1L硫酸溶液中含有96gSO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com