
科目:高中化学 来源:2012年苏教版高中化学选修2 5.4 化学农药的发展练习卷(解析版) 题型:填空题
我国是个农业大国,农业是立国之本,“农村、农业、农民”是党中央新时期农村工作的重心,化肥与农药的发展起着巨大的推动作用,请回答下列问题:
(1)农作物生长过程中不可缺少的微量元素有Fe、Mn、B、Cu、Mo等,它们或是酶的组成成分,或能提高酶的活性,是农作物体内营养物质的形成和新陈代谢不可缺少的。常用铜肥是胆矾,在盐碱地(土壤pH>7)施用胆矾时宜将溶液________(填“喷在叶片上”或“随水灌入土壤中”),主要理由是_______________________________________________________
________________________________________________________________________。
(2)农药波尔多液是一种常用的杀菌剂,常用配方为胆矾、生石灰、水,按质量比1∶0.56∶100混合,分析其防治病虫害的原因________________________________________。
(3)拟除虫菊酯是一种高效、低毒,对昆虫有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图:

其分子式为________________________,则下列对该化合物的叙述正确的是________(填字母代号)。
A.该化合物属于芳香烃
B.该化合物属于卤代烃
C.该化合物在碱性条件下失去药效
D.该化合物在一定条件下可发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
(13分)
(1) 用NH3做主要原料按下列流程生产化肥NH4NO3。其中a%、b%、c%分别表示对应反应的转化率,NH3与HNO3反应生成NH4NO3原料利用率为100%
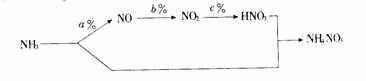
若用1tNH3为原料,为了使制得的NH4NO3产量最大,则用于制HNO3的NH3质量为 t(用含a、b、c的代数式表示)
(2) 铵态氮肥在碱性条件下使用会导致肥效损失,NH4H2PO4溶液与足量NaOH溶液共热反应的离子方程式为 。
(3) 一种复合肥料含有NH4NO3 、NH4H2PO4、KCl,取其一定量溶于水形成溶液,测得其中部分离子浓度为:c(NH4+)=3mol•l-1,c(H2PO4-)=2mol•l-1,c(K+)=2mol•l-1,则配制该复合肥料所取的NH4NO3 、NH4H2PO4、KCl的物质的量之比为 。
(4) 人们一直致力于人工固氮的研究以获得廉价的氮肥。科学家先后提出并合成固氮酶的多种模拟物。其中一类是含Mo、Fe、S原子的“类立方体”结构,如图所示:
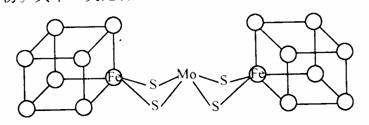
图中左、右两边对称,各含一个近似为立方体的结构。每个立方体含有4个Fe原子、4个S原子,它们位于立方体的8个顶点,且原子间只有一种化学键。
①请在图中左边立方体的○中填写出其余3个Fe原子。
②上述一个立方体中4个Fe原子所在的顶点连接所构成的空间几何体为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com