
| A. | H、D、T属于同位素,H2、D2、T2属于同素异形体 | |
| B. | 氯水、氨水、王水是混合物,水银、水玻璃是纯净物 | |
| C. | 冰醋酸、纯碱、小苏打分别属于酸、碱、盐 | |
| D. | 水能、风能、生物质能是可再生能源,煤、石油、天然气是不可再生能源 |
分析 A.质子数相同,而中子数不同的原子互为同位素;分子式相同,但结构不同的有机化合物互为同分异构体;
B.混合物是两种或两种以上的物质组成,纯净物是单一的一种物质;
C.纯碱是盐;
D.能够源源不断的从自然界得到补充的能源叫可再生能源.
解答 解:A.H、D、T都是H元素的不同原子,属于同位素,H2、D2、T2由氢元素形成的单质,结构相同,属于同种物质,故A错误;
B.水玻璃是硅酸钠的水溶液,是混合物,故B错误;
C.纯碱是碳酸钠,属于盐类,故C错误;
D.风能和水能,生物质能是通过太阳光的照射和水的循环来形成的,太阳光可以源源不断的从自然界得到,是可再生能源,煤、石油和天然气属于三大化石燃料,都属于不可再生的能源,故D正确.
故选D.
点评 本题考查同位素,同素异形体,混合物,纯净物,酸碱盐,可再生资源等,难度不大,平时注意知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 蔗糖、麦芽糖互为同分异构体 | |
| B. | 常用蛋白质的颜色反应来鉴别部分蛋白质 | |
| C. | 用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3 | |
| D. | 油脂在酸性或碱性条件下均能发生水解反应,且产物不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
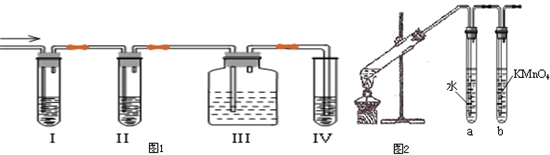
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 酸 | HCN | HAc | HF | H2SO3 |
| Ka | 4.9×10-10 | 1.75×10-5 | 3.5×10-4 | K1=1.5×10-2 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
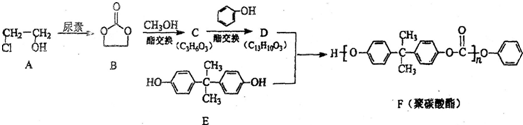
 )结构
)结构 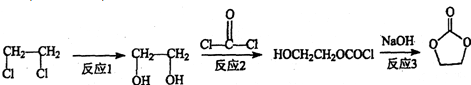

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,14.0g乙烯和丁烯的混合气体中含有的C-H键数目为2NA | |
| B. | 2molSO2和1molO2在一定条件下充分反应后,所得混合气体的分子数大于2NA | |
| C. | 2.3g金属钠与过量的氧气反应,无论是否加热,转移的电子数均为0.1NA | |
| D. | 1mol Na2CO3晶体中含有的CO32-离子数小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
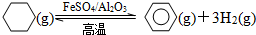
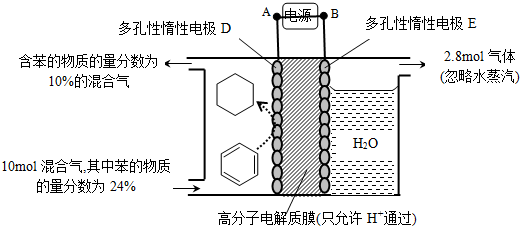
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com