
分析 (1)①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol,
②4NH 3 (g)+5O 2 (g)?4NO(g)+6H 2O(l)△H=-1168.8kJ/mol,
③N2(g)+O 2(g)═2NO(g)△H=+180.6kJ/mol,
根据盖斯定律,①×3+③-$\frac{1}{2}$×②可得N2(g)+3H2(g)═2NH 3 (g)△H;
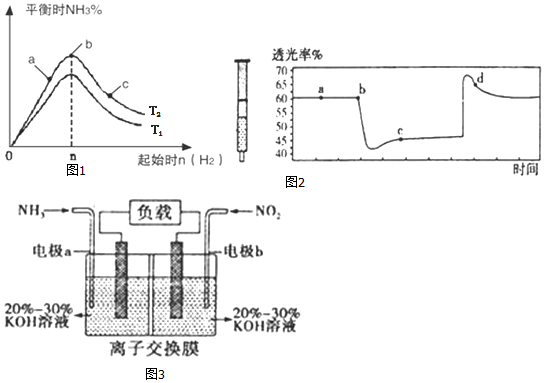
(2)①根据温度升高化学平衡向着吸热方向进行;
②根据a、b、c三点所表示的意义,结合化学平衡移动的方向进行判断;
③根据反应物的物质的量之比为等于化学计量数之比时,达平衡状态时生成物的百分含量最大;先求出各自的平衡浓度,然后根据平衡常数的概念来回答;
(3)该反应是正反应气体体积减小的放热反应,压强增大平衡虽正向移动,但二氧化氮浓度增大,混合气体颜色变深,压强减小平衡逆向移动,但二氧化氮浓度减小,混合气体颜色变浅,据图分析,b点开始是压缩注射器的过程,气体颜色变深,透光率变小,c点后的拐点是拉伸注射器的过程,气体颜色变浅,透光率增大,据此分析;
(4)①由反应6NO2+8NH3═7N2+12H2O可知,反应中NO2为氧化剂,NH3为还原剂,则a为负极,b为正极;负极失电子发生氧化反应据此书写点击方程式;
②当有0.1mol NO2被处理时,转移电子为0.1mol×(4-0)=0.4mol,据此进行分析;
③原电池工作时,阴离子向负极移动,为使电池持续放电,离子交换膜需选用阴离子交换膜,防止二氧化氮反应生成硝酸盐和亚硝酸盐,导致原电池不能正常工作.
解答 解:(1)氢气的燃烧热为285.8kJ/mol,可得①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol,
②4NH 3 (g)+5O 2 (g)?4NO(g)+6H 2O(l)△H=-1168.8kJ/mol,
③N2(g)+O 2(g)═2NO(g)△H=+180.6kJ/mol,
根据盖斯定律,①×3+③-$\frac{1}{2}$×②可得N2(g)+3H2(g)═2NH 3 (g)△H=(-285.8kJ/mol)×3+(+180.6kJ/mol)-$\frac{1}{2}$×(-1168.8kJ/mol)=-92.4kJ/mol,
故答案为:N2(g)+3H2(g)═2NH 3 (g)△H=-92.4kJ/mol;
(2)①反应为放热反应,温度升高化学平衡向着吸热方向进行,从T1到T2反应物氮气的量增加,故T1<T2,
故答案为:高于;
②c点氢气的物质的量比ab点多,平衡向右移动,氮气的转化率增大,
故答案为:c;
③当氮气和氢气的物质的量之比为1:3时达平衡状态时氨的百分含量最大,平衡点时产物的产率最大,据图示,当平衡时氢气的物质的量为n,故加入N2的物质的量为$\frac{1}{3}$n,当n=3mol反应达到平衡时H2的转化率为60%,故起始氮气浓度为1mol/L,变化的氢气浓度为1.8mol/L,变化的氮气浓度为0.6mol/L,平衡时氮气、氢气、氨气的浓度分别是0.4mol/L、1.2mol/L、1.2mol/L,据K=$\frac{[N{H}_{3}]^{2}}{[{N}_{2}]•[{H}_{2}]^{3}}$=$\frac{1×{2}^{2}}{0.4×1.{2}^{3}}$=$\frac{25}{12}$,
故答案为:$\frac{25}{12}$;
(3)A、b点开始是压缩注射器的过程,气体颜色变深,透光率变小,故A正确;
B、c点是压缩注射器后的情况,二氧化氮和四氧化二氮的浓度都增大,故B错误;
C、b点开始是压缩注射器的过程,平衡正向移动,反应放热,导致T(b)<T(c),升温平衡逆向移动,平衡常数减小,所以Kb>Kc,故C正确;
D、c点后的拐点是拉伸注射器的过程,d点是平衡向气体体积增大的逆向移动过程,所以v(逆)>v(正),故D错误;
故答案为:AC;
(4)①由反应6NO2+8NH3═7N2+12H2O可知,反应中NO2为氧化剂,NH3为还原剂,则a为负极,b为正极,负极电极方程式为2NH3-6e-+60H-=N2+6H2O,
故答案为:负;2NH3-6e-+60H-=N2+6H2O;
②当有0.1mol NO2被处理时,转移电子为0.1mol×(4-0)=0.4mol,
故答案为:0.4;
③原电池工作时,阴离子向负极移动,为使电池持续放电,离子交换膜需选用阴离子交换膜,防止二氧化氮反应生成硝酸盐和亚硝酸盐,导致原电池不能正常工作,
故答案为:阴离子.
点评 本题主要考查的是反应热的计算、化学反应平衡移动与图象、电化学等知识,综合性较强,难度较大,注意氧化还原反应原理在电化学中的应用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Mg(OH)2不能转化为Ca(OH)2 | B. | Ca(OH)2的溶解度最小 | ||
| C. | Ca(OH)2不能转化为 Mg(OH)2 | D. | Ksp越大,S不一定越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
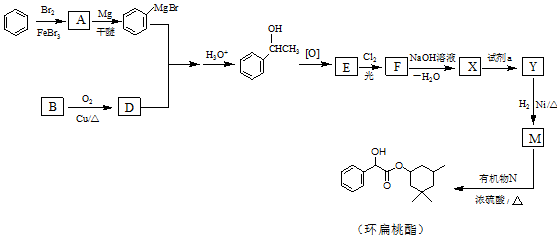
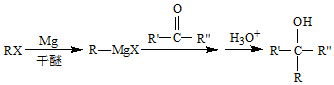 (R、R′、R″代表烃基或氢)
(R、R′、R″代表烃基或氢)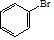 .
.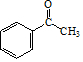 .
.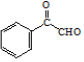 .
.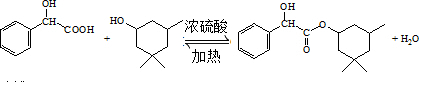 .
.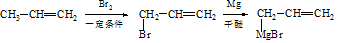
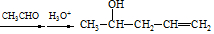
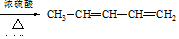 (用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com