
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。元素Z的原子最外层电子数是其内层的3倍。
(1)X与Y所形成化合物晶体的晶胞如图所示。
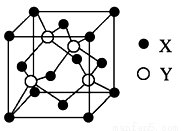
①在一个晶胞中,X离子的数目______;
②该化合物的化学式为______________;
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是____________;
(3)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是____________;
(4)Y与Z可形成YZ42-。
①YZ42-的空间构型为____________(用文字描述);
②写出一种与YZ42-互为等电子体的分子的化学式____________;
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有δ键的数目为________;
 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源:2016届福建省闽粤联合体高三上学期第三次联考化学试卷(解析版) 题型:选择题
下列有关离子检验的操作和实验结论都正确的是
选项 | 实验操作及现象 | 实验结论 |
A | 向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶解 | 该溶液中一定含有SO42- |
B | 浓硫酸滴入蔗糖中,搅拌得黑色蓬松的固体并有刺激性气味 | 该过程中浓硫酸仅体现吸水性和脱水性 |
C | 在酒精灯上加热铝箔,铝箔熔化,但不滴落,好像有一层膜兜着 | 铝易被氧化;铝的熔点比氧化铝低 |
D | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体 | 该溶液中一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高一上第二次月考化学试卷(解析版) 题型:选择题
下列关于NaHCO3的叙述,不正确的是
A.它是一种白色粉末,溶解度小于Na2CO3
B.加热至200℃左右,可完全分解,利用这种性质,可由NaHCO3制取纯碱
C.与Na2CO3相同质量时,分别跟足量盐酸反应后,则NaHCO3可得到较多的二氧化碳
D.它是一种碳酸盐
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上期中考试化学试卷(解析版) 题型:选择题
下列事实中,与电化学腐蚀无关的是
A.在空气中,光亮的银表面逐渐变暗
B.为保护海轮的船壳,常在船壳上镶入锌块
C.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀
D.镀锡的铁制品,镀层部分受损后,露出的铁表面易被腐蚀
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上期末理综化学试卷(解析版) 题型:填空题
研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)已知拆开1 mol H2、1 mol O2和液态水中1 mol O—H键使之成为气态原子所需的能量分别为436 kJ、496 kJ和462 kJ;CH3OH(g)的燃烧热为627 kJ·mol-1。
则CO2(g)+3H2(g)=CH3OH(g)+H2O(l) ∆H= kJ·mol-1
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g)  CH3OCH3(g)+3H2O(l)
CH3OCH3(g)+3H2O(l)
①该反应平衡常数表达式K= 。
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。该反应的∆H 0,(填“>”或“<”)。若温度不变,减小反应投料比[n(H2)/n(CO2)],则K将 (填“增大”、“减小”或“不变”)。

③某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,当下列物理量不再发生变化时,能表明上述可逆反应达到化学平衡的是 。
A.二氧化碳的浓度 B.容器中的压强
C.气体的密度 D.CH3OCH3与H2O的物质的量之比
(3)向澄清的石灰水中通入CO2至溶液中的Ca2+刚好完全沉淀时,则溶液中c(CO32 -)= 。[已知:Ksp(CaCO3)=2.8×10-9]
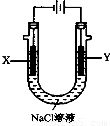
(4)以甲醚、空气、氢氧化钾溶液为原料的燃料电池为电源,以石墨为电极电解500 mL滴有酚酞的NaCl溶液,装置如图所示:请写出电解过程中Y 电极附近观察到的现象 ;当燃料电池消耗2.8L O2(标准状况下)时,计算此时:NaCl溶液的pH= (假设溶液的体积不变,气体全部从溶液中逸出)。
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上四次模拟化学卷(解析版) 题型:选择题
下列说法正确的是
A.氢气的燃烧热为△H=-285.5kJ•mol-1,则电解水的热化学方程式为2H2O(l) 2H2(g)+O2(g) △H=+285.5k•Jmol-1
2H2(g)+O2(g) △H=+285.5k•Jmol-1
B.反应SO2(g)+2H2S(g)=3S(s)+2H2O(l)在常温下能自发进行,则该反应的△H<0
C.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) +3H2(g)═2NH3(g)△H=-38.6k•Jmol-1
D.由C(石墨,s)=C(金刚石,s) △H=+1.90 k•Jmol-1可知,金刚石比石墨稳定
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高一上学期期中考试化学试卷(解析版) 题型:填空题
综合利用海水可以制备食盐、纯碱、金属镁等物质,其流程如下图所示:

(1)反应①~⑤中,属于氧化还原反应的是 。
(2)写出反应②的离子方程式 。
(3)X溶液中的主要阳离子是Na+和 。
(4)粗盐中含有Na2SO4、MgCl2、CaCl2等杂质,为制得纯净的NaCl晶体,操作如下:
①溶解;②依次加入过量的BaCl2溶液、NaOH溶液、Na2CO3溶液;
③ ;④加适量盐酸;⑤ (请补全缺少的实验步骤)。
(5)检验纯碱样品中是否含NaCl应选用的试剂是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一上学期12月月考化学试卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式的是
A.硫酸铝溶液中加入过量氨水:Al3++3OH-===Al(OH)3↓
B.用惰性电极电解MgCl2溶液:2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C.冷的氢氧化钠溶液中通入氯气:Cl2+2OH-===ClO-+Cl-+H2O
D.碳酸钙与醋酸溶液反应 CaCO3 +2H+ = Ca2+ +CO2 ↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com