
【题目】中国营养学会修订颁布的“每日膳食营养素供给量”将硒(Se)列为15种每日膳食营养素之一,提出一个成年人每天对硒的适宜摄入量是50 ~250μg。回答下列有关问题:
(1) Se 原子的价电子排布式为_______,基态78 Se 原子中,核外存在______对自旋方向相反的电子。
(2)碱金属的硒化物溶液能够溶解硒,生成多硒化合物(M2Sex)。如多硒化钠Na2Se8,该物质中,化学键类型是________,Se原子之间形成的空间构型为_________________。
(3)As、S在元素周期表中均与Se 相邻,其氢化物分别是AsH3、H2Se和H2S其氢化物的稳定性强弱顺序为______________________。
(4)SeCl2和BeCl2均为1:2组成的分子,SeCl2中Se的轨道杂化类型是_______,BeCl2中Be的轨道杂化类型是_________________。
(5)Zn与Se同周期,S与Se同主族。由Zn与S形成的ZnS可用于制白色的颜料及玻璃、发光粉、橡胶、塑料、发光油漆等。ZnS晶胞结构如图所示,黑球代表的原子在晶胞内,白球代表的原子除在顶点外,其余的原子在晶胞_________ (填“内部”“棱上”或“面心”),若该晶体的密度为ρg·㎝-3,阿伏加德罗常数为NA mol-1,则立方晶胞的棱长=_____㎝(用含p、NA的代数式表示)。
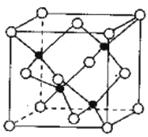
【答案】 4s24p4 16 离子键、共价键(或答“非极性共价键”,2分) 折线形或锯齿形或V形 H2S>H2Se>AsH3 sp3 sp 面心 ![]() 或
或![]()
【解析】本题考查选修3《物质结构》,主要考查基础知识,(1)Se位于第四周期VIA族元素,主族元素价电子指最外层电子数,Se的价电子排布式为4s24p4;每一个轨道最多容纳2个电子,且自旋方向相反,即Se有16对自旋方向相反的电子;(2)此物质为离子化合物,即含有离子键,Na最外层只有1个电子,因此Se原子间以共价键的形式结合,Se是sp3杂化,因此空间构型为V形;(3)同主族从上到下非金属性减弱,同周期从左向右非金属性增强,即S>Se>As,非金属性越强,其氢化物越稳定,即H2S>H2Se>AsH3;(4)SeCl2中Se形成2个σ键,孤电子对数=(6-2×1)/2=2,杂化类型为sp3,BeCl2中Be有2个σ键,孤电子对数=(2-2×1)/2=0,杂化类型为sp;(5)根据晶胞的结构,其余原子在晶胞的面心,晶胞的质量为4×97/NAg,设晶胞的边长为acm,则晶胞的体积为a3cm3,根据密度的定义,则a=![]() 或
或![]() 。
。


科目:高中化学 来源: 题型:
【题目】将6 mol H2和3 mol CO充入容积为0.5 L的密闭容器中,进行如下反应:
2H2(g)+CO(g)![]() CH3OH(g),6秒末时容器内压强为开始时的0.6倍。
CH3OH(g),6秒末时容器内压强为开始时的0.6倍。
试计算:(1)H2的反应速率是多少?(2)CO的转化率为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X和H是固体,B和G是液体,其余均为气体,1 mol X分解得到A、B、C各1 mol。
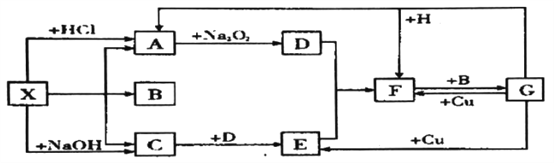
试回答下列各题:
(1)写出下列物质的化学式:X______,B_________。
(2)写出下列反应的化学方程式:
①G+H→A+F:____________________;
②C+D→E:________________。
(3) 写出下列反应的离子方程式:
G+Cu→E:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是最常见的金属材料。铁能形成[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(III)〕 和Fe(CO)x等多种配合物。
(1)基态Fe3+的核外电子排布式为_____,与NO3-互为等电子体的分子是__________。
(2)尿素(H2NCONH2)分子中C、N原子的杂化方式依次为______。C、N、O三种元素的第一电离能由大到小的顺序是______。
(3)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=______。Fe(CO)x常温下呈液态,熔点为-20 .5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于_______(填晶体类型)。
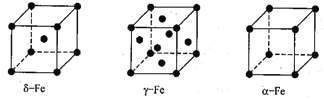
(4)铁有δ、γ、a三种同素异形体,δ、γ、a三种晶胞中铁原子的配位数之比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着机动车的拥有量逐年升高,机动车尾气的污染也越来越受到人们的关注。因机动车尾气的排放可能造成光化学烟雾污染的气体是
A.SO2 B.NO2 C.CO2 D.CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列科学成果中,由我国化学家在现代化学研究中取得的是( )
A.发现放射性元素钋和镭 B.现代量子化学的创立
C.人工合成牛胰岛素 D.元素周期律的发现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电解质的电离方程式错误的是( )
A. HCl =H++C1- B.NaOH =Na++O2-+ H+
C.BaCl2 =Ba2++2C1- D.CuSO4=Cu2++SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜灰渣(含有Cu、Zn、CuO、ZnO及少量的FeO、Fe2O3)生产硝酸铜溶液的流程如下:
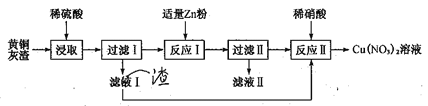
(1)写出酸浸时Fe2O3和稀硫酸反应的离子方程式:_________________。
(2)反应I中所加Zn不能过量的原因是________________。
(3)滤液II中含有的金属阳离子主要有_____________。
(4)写出反应II的离子方程式:______________。反应II应控制温度不能过高也不能过低的原因是___________________。
(5)已知Cu(NO3)2·6H2O和Cu(NO3)2·3H2O的溶解度随温度的变化如图所示。则由A点对应的溶液获取Cu(NO3)2·3H2O的方法是_______________。
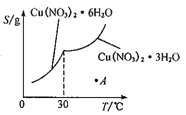
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关硅元素的下列叙述中正确的是( )
A. 常温时硅可和强碱及强酸溶液反应
B. 硅与任何酸都不反应
C. 硅是构成矿物岩石的主要原料,其化合态硅几乎全部是硅石和硅酸盐
D. 硅的性质很稳定,能以游离态存在于自然界
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com