
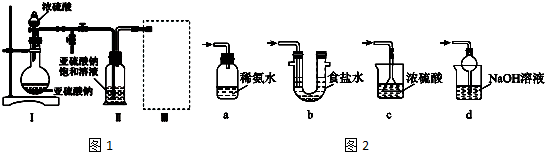

分析 (1)由装置Ⅱ中发生的反应可知,装置Ⅰ中产生的气体为SO2,亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫与水;
(2)根据装置图可知盛装浓硫酸的仪器名称;
(3)装置Ⅲ用于处理尾气,吸收为反应的二氧化硫,应防止倒吸,且不能处于完全密闭环境中;
(4)NaHSO3溶液中HSO3-的电离程度大于水解程度,溶液呈酸性,故检验溶液呈酸性即可;
(5)Na2S2O5晶体在空气中易被氧化为Na2SO4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可;
(6)①碘具有氧化性,能氧化乳胶管,所以要用酸式滴定管;
②碘遇淀粉显蓝色,据此选择指示剂;
③用标准I2溶液滴定时,达到滴定终点,溶液中有碘单质,遇淀粉显蓝色;
④若有部分HI被空气氧化,则消耗碘的量偏小,故测定二氧化硫的量偏小.
解答 解:(1)由装置Ⅱ中发生的反应可知,装置Ⅰ中产生的气体为SO2,亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫与水,反应方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)根据装置图可知盛装浓硫酸的仪器名称为分液漏斗,
故答案为:分液漏斗;
(3)a.装置应将导管深入氨水中可以吸收二氧化硫,但为密闭环境,装置内压强增大易产生安全事故,故错误;
b.该装置吸收二氧化硫能力较差,且为密闭环境,装置内压强增大易产生安全事故,故错误;
c.该装置不能吸收二氧化硫,所以无法实现实验目的,故错误;
d.该装置中氢氧化钠与二氧化硫反应,可以吸收,且防止倒吸,故正确;
故答案为:d;
(4)NaHSO3溶液中HSO3-的电离程度大于水解程度,溶液呈酸性,测定溶液的pH,可以确定溶液酸碱性,酸性溶液可以使湿润蓝色石蕊试纸变红,所以能用测定溶液pH值、湿润的蓝色石蕊试液检验,而加入Ba(OH)2溶液、HCl溶液、品红溶液都不能说明溶液呈酸性,故选ae;
故答案为:ae;
(5)Na2S2O5中S元素的化合价为+4价,因此会被氧化为为+6价,即晶体在空气中易被氧化为Na2SO4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可,实验方案为:取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成,
故答案为:取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成;
(6)①碘具有氧化性,能氧化乳胶管,所以要用酸式滴定管,
故答案为:酸式;
②碘遇淀粉显蓝色,所以该滴定实验所用的指示剂为淀粉溶液,
故答案为:淀粉溶液;
③用标准I2溶液滴定时,达到滴定终点,溶液中有碘单质,遇淀粉显蓝色,所以滴定终点的现象 为当滴入最后一滴碘水溶液,溶液由无色变为蓝色,且半分钟不褪色,
故答案为:当滴入最后一滴碘水溶液,溶液由无色变为蓝色,且半分钟不褪色;
④若有部分HI被空气氧化,则消耗碘的量偏小,故测定二氧化硫的量偏小,则测定结果偏低,
故答案为:偏低.
点评 本题考查物质的制备实验、实验方案设计、物质含量的测定、氧化还原反应滴定等,难度中等,明确实验原理是解本题关键,根据物质的性质分析解答,注意元素化合物知识的积累和灵活运用.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCl2完全反应转移电子数一定为2×6.02×1023 | |
| B. | 因SO2具有漂白性,故可使品红溶液、酸性KMnO4溶液褪色 | |
| C. | 常温下,$\frac{c(OH-)}{c(H+)}$=10-10的溶液中:Na+、Al3+、SO42-、NO3-可大量共存 | |
| D. | 将20.0gNaOH固体置入500mL容量瓶,然后加水至刻度线即得1.00mol/L的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体中NO与O2的体积之比为4:1 | |
| B. | 水吸收后的剩余气体是O2,且c=$\frac{a}{6}$ | |
| C. | 取m g AgNO3溶于水再加足量盐酸可生成沉淀$\frac{2a}{3×22.4}$×143.5g | |
| D. | 水吸收后所得溶液中HNO3的物质的量浓度为$\frac{b}{108}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| a | b | c | |
| A | 2 | 1 | 1 |
| B | 1 | 1 | 0 |
| C | 1 | 0 | 1 |
| D | 0 | 1 | 2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:填空题
将物质的量均为3.00mol物质A、B混合于5L容器中,发生如下反应 3A+B 2C,在反应过程中C的物质的量分数随温度变化如图所示:
2C,在反应过程中C的物质的量分数随温度变化如图所示:
(1)T0对应的反应速率v正__________v逆。(填“>”“<”或“=”);
(2)此反应的正反应为___________热反应。(填“吸”或“放”);
(3)X、Y两点A物质正反应速率的大小关系是Y___________X;(填“>”“<”或“=”);
(4)若Y点的C的物质的量分数为25%,则参加反应的A的物质的量为____________mol;若Y点时所耗时间为2min,则B物质的反应速率为__________mol/(L·min)。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 6种 | C. | 7种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ⅠFe(s)+CO2(g)=FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ⅡFe(s)+H2O(g)=FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ⅢCO(g)+H2O(g)=CO2(g)+H2(g) | K3 | ? | ? |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na放置在空气中生成淡黄色的Na2O2固体 | |
| B. | Fe在O2中燃烧产物可用于制红色涂料 | |
| C. | Na、Al、Cu可以分别用电解冶炼法、热还原法和热分解法得到 | |
| D. | FeCl2溶液中滴加氨水至过量,加热蒸干溶液,最后灼烧可得到Fe2O3固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com