
| A. | Cu(OH) 2 | B. | Cu | C. | CuSO4 | D. | CuO |
分析 电解硫酸铜溶液反应式为:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2 Cu+O2 ↑+2H2SO4,从溶液中析出的物质是氧气和铜,二者物质的量之比为1:2,故相当于析出CuO,加入CuO可以恢复原溶液浓度.
解答 解:电解硫酸铜溶液反应式为:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2 Cu+O2 ↑+2H2SO4,从溶液中析出的物质是氧气和铜,二者物质的量之比为1:2,故相当于析出CuO,氧化铜能与硫酸反应,故向溶液中加入与形成的Cu物质的量相等的氧化铜即可恢复到原浓度,故选D.
点评 本题考查电解原理,根据溶液中离子的放电顺序明确发生的反应是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 通过足量的NaOH溶液 | B. | 通过足量的溴水 | ||
| C. | 在Ni催化、加热条件下通入H2 | D. | 通过足量的酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M的相对原子质量为32 | B. | M的相对原子质量为64 | ||
| C. | 电解过程中溶液的pH不发生变化 | D. | 电路中通过0.05mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-乙基-1,3-丁二烯分子的键线式: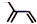 | |
| B. | 3-己炔的结构简式:CH3CH2CCCH2CH3 | |
| C. | 聚丙烯的结构简式: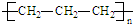 | |
| D. | 羟基的电子式: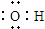 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 298K时,CaSO4的溶解度约为7.00×10-2mol/L | |
| B. | 反应CaSO4(s)+CO32-=CaCO3(s)+SO42-在298K时的平衡常数K=Ksp(CaSO4)/Ksp(CaCO3)=1.75×104 | |
| C. | CaCO3、CaSO4的饱和溶液的导电能力很弱,所以它们都是弱电解质 | |
| D. | 升高温度,两种盐的溶度积与溶解度都保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
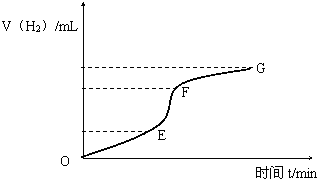 用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com