
| A. | 蛋白质遇浓硝酸变黄 | |
| B. | 含钠元素的物质在火焰上灼烧产生黄色火焰 | |
| C. | pH试纸与某溶液接触变为红色 | |
| D. | 无色浓硝酸久置后变黄 |
分析 A.蛋白质遇浓硝酸发生颜色反应;
B.焰色反应是物理性质;
C.pH试纸与某溶液接触变为红色有新物质生成;
D.浓硝酸不稳定,易分解生成NO2,NO2能溶于浓硝酸.
解答 解:A.蛋白质遇浓硝酸发生颜色反应呈黄色,有新物质生成,属于化学变化,故A正确;
B.焰色反应是物理性质,没有新物质生成,故B错误;
C.pH试纸与某溶液接触变为红色有新物质生成,属于化学变化,故C正确;
D.浓硝酸不稳定,易分解生成NO2,NO2是红棕色气体,NO2溶于浓硝酸而使溶液呈黄色,有新物质生成,属于化学变化,故D正确.
故选B.
点评 本题考查蛋白质的性质、焰色反应、pH试纸使用以及硝酸的性质等知识,难度较小,旨在考查学生对基础知识的识记,注意基础知识的积累掌握.


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:选择题
| A. | 钠是银白色金属,熔点低,硬度大 | |
| B. | 钠放置于空气中,会迅速被氧化而生成淡黄色的氧化钠 | |
| C. | 在氧气中加热时,金属钠剧烈燃烧,黄色火焰 | |
| D. | 金属钠着火可以用水灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| 步骤I: ① . 步骤II:配制与0.1 mol/L Fe(NO3)3 溶液所含c (H+)、 c (NO3-) 相同的溶液,取适量此溶液放入到新制备的银镜中. | ② ,乙同学的推测 成立;反之,则不成立. |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R表示处方药,OTC表示非处方药 | |
| B. | 毒品就是有毒的药品,所以不能使用有毒药品 | |
| C. | 胃酸过多,会产生酸中毒,可以用碳酸钠中和胃酸 | |
| D. | 麻黄碱是天然药物,国际奥委会没有严格禁止在运动员中使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 物质 | 杂质 | 所加试剂 | 分离方法 |
| (1) | NO | NO2 | ||
| (2) | Fe粉 | Al粉 | ||
| (3) | 氯化钠固体 | 氯化铵固体 | / |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
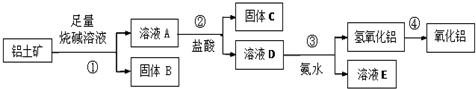
 .
.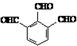 .
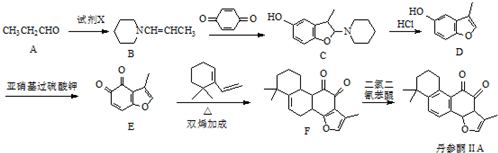
.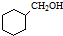 的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:CH3CHO$→_{催化剂,△}^{O_{2}}$CH3COOH$→_{浓H_{2}SO_{4},△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.
的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:CH3CHO$→_{催化剂,△}^{O_{2}}$CH3COOH$→_{浓H_{2}SO_{4},△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═[Al(OH)4]-+4NH4+ | |
| B. | MgSO4溶液中加入Ba(OH)2溶液:SO42-+Ba2+=BaSO4↓ | |
| C. | 硫化钠溶液显碱性:S2-+2H2O═H2S+2OH- | |
| D. | NaHCO3溶液加入少量Ca(OH)2溶液:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com