
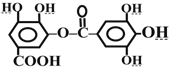
| A. | 该有机物的分子式为C14H10O9 | |
| B. | 常温下,与Na2CO3溶液反应放出CO2 | |
| C. | 与稀H2SO4共热,生成两种有机物 | |
| D. | 能发生碱性水解,1mol该有机物完全反应消耗8molNaOH |
分析 A.有机物中含有14个C、10个H以及9个O;
B.-COOH和碳酸钠反应生成二氧化碳;
C.水解后的产物均含3个相邻的酚-OH,1个-COOH;
D.酚-OH、-COOH和酯基水解生成的酚-OH、-COOH都能和NaOH反应.
解答 解:A.有机物中含有14个C、10个H以及9个O,则分子式为C14H10O9,故A正确;
B.-COOH和碳酸钠反应生成二氧化碳,该物质中含有羧基,所以能与碳酸钠反应生成二氧化碳,故B正确;
C.水解后的产物均含3个相邻的酚-OH,1个-COOH,所以其水解产物是一种,故C错误;
D.酚-OH、-COOH和酯基水解生成的酚-OH、-COOH都能和NaOH反应,1mol该物质完全水解后生成6mol酚羟基、2mol羧基,所以1mol该有机物完全反应消耗8molNaOH,故D正确;
故选C.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断能力,明确酚、羧酸性质是解本题关键,注意:羧基能和碳酸钠反应生成二氧化碳,酚羟基和碳酸钠反应生成碳酸氢钠和酚钠,题目难度不大.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一上10月月考化学试卷(解析版) 题型:计算题
CO和CO2的混合气体36g,完全燃烧后测得CO2的体积为22.4 L(标准状况下)。
(1)求混合气体中CO的质量。
(2)混合气体中CO2在标准状况下的体积。
(3)混合气体在标准状况下的密度。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚有杀菌和止痛作用,药皂中也掺入少量的苯酚,所以我们可以用苯酚进行消毒或直接涂抹到皮肤上起消毒作用 | |
| B. | 工业酒精不能加水而当美酒品尝,因其中含有甲醇,它虽然也具有酒香气味,但饮后会造成人的双目失明甚至死亡 | |
| C. | 蜂蚁叮咬人的皮肤时将分泌物甲酸注入人体,此时可在患处涂抹小苏打或稀氨水 | |
| D. | 不粘锅的表面涂有聚四氟乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 粒子 | I2 | Br2 | IO |
| 物质的量/mol | 0.5 | 1.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ”或“
”或“ ”表示化学键断裂处,“
”表示化学键断裂处,“ ”表示生成的化学键( )
”表示生成的化学键( )| A. | 乙醇催化氧化: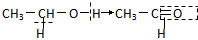 | B. | 乙酸和乙醇的酯化反应: | ||
| C. | 溴乙烷的消去反应: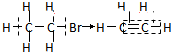 | D. | 乙醛的还原反应: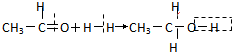 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com