
压强变化不会使下列化学反应的平衡发生移动的是( )
A.H2(g)+Br2(g)  2HBr (g) B.N2(g)+3H2(g)
2HBr (g) B.N2(g)+3H2(g)  2NH3(g)
2NH3(g)
C.2SO2(g)+O2(g)  2SO3(g) D.C(s)+CO2(g)
2SO3(g) D.C(s)+CO2(g)  2CO(g)
2CO(g)
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:_____________________________________________。
(2)[2013·广东理综,32(3)]完成煅烧过程中一个反应的化学方程式:________CuO+________Al2O3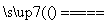 ________CuAlO2+________↑。
________CuAlO2+________↑。
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.1.8 g重水(D2O)中含有的质子数和电子数均为1.0NA
B.500℃ 30 MPa下,N2(g)+3H2(g)2NH3(g) ΔH=-38.6 kJ·mol-1。将分子数为1.5NA的H2和过量N2在此条件下充分反应,放出热量19.3 kJ
C.标准状况下,将11.2 L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA
D.15 g石英晶体中含有的Si—O键数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:__________________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是________________________________。
(3)吸收液吸收SO2的过程中,pH随n(SO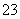 )∶n(HSO
)∶n(HSO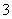 )变化关系如下表:
)变化关系如下表:
| n(SO | 91∶9 | 1∶1 | 1∶91 |
| pH | 8.2 | 7.2 | 6.2 |
上表判断NaHSO3溶液显________性,用化学平衡原理解释:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实不能用勒夏特列原理解释的是( )。
A.溴水中有Br2+H2O HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
B.加催化剂,使N2和H2在一定条件下转化为NH3
C.反应CO(g)+NO2(g)  CO2(g)+NO(g) ΔH<0,达平衡后,升高温度体系颜色变深
CO2(g)+NO(g) ΔH<0,达平衡后,升高温度体系颜色变深
D.增大压强,有利于SO2与O2反应生成SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应2SO2(g)+O2 (g) 2SO3(g),下列判断中正确的是( )
2SO3(g),下列判断中正确的是( )
A.2体积SO2和足量O2反应,生成 2体积SO3
B.恒温恒容,通入气体氦使压强增大,平衡向右移动
C.平衡时,SO2消耗速率等于O2生成速率的两倍
D.平衡时,SO2浓度等于O2浓度的两倍
查看答案和解析>>
科目:高中化学 来源: 题型:
将NO2装入带活塞的密闭容器中,当反应2NO2(g) 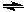 N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是 ( )
N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是 ( )
A.升高温度,气体颜色加深,则此反应为吸热反应
B.慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅
C.慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D.恒温恒容时,充入惰性气体,压强增大,平衡向右移动,混合气体的颜色变浅
|
温度/℃ | 1 | 2 | 4 |
| 100 | 1.00 | 0.75 | 0.53 |
| 200 | 1.20 | 0.90 | 0.63 |
| 300 | 1.30 | 1.00 | 0.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:
重铬酸钾 A是橙红色的固体,有强氧化性。①将其用浓盐酸处理产生黄绿色刺激性气味气体B和蓝紫色溶液C;②在C中加入KOH溶液,先生成灰蓝色沉淀D;③继续加入过量的KOH溶液则沉淀消失,变成绿色溶液E;④在E中加入H2O2加热则生成黄色溶液F,⑤F用稀硫酸酸化,又变成原来的化合物A的溶液。
已知:氢氧化铬在溶液中存在如下平衡:
Cr3++3OH- Cr(OH)3
Cr(OH)3 H2O+HCrO2
H2O+HCrO2 H2O +H++ CrO2-
H2O +H++ CrO2-
蓝紫色 灰蓝色 绿色
(1)根据上述平衡判断氢氧化铬具有____________(填“碱性”、“酸性”、“两性”)。
(2)写出①的离子方程式______________________________________________;
(3)已知D的溶解度为2.06×10-7g ,则D的溶度积常数为______________。
(4)写出③的离子反应方程式________________________________________
(5)④F溶液中的黄色离子是__________(写化学式);若参加反应的H2O2是5mol,则生成的黄色离子的物质的量为__________________。
(6)金属锡(Sn)是第ⅣA的元素,通过下列方法可以测定金属锡样品的纯度:
①将试样溶于盐酸中,发生的反应化学方程式为:__________________________________;
②向①的溶液中再加入过量的FeCl3溶液,发生的反应化学方程式为_________________;
③用已知浓度的A溶液滴定生成的Fe2+。现有金属锡样品wg,经上述各步反应后,用A溶液滴定,A应放在__________(填“酸式”或“碱式”)滴定管中,共用去cmol·L-1的A溶液vmL(锡的相对原子质量用M表示)。求样品中锡的质量分数为_____________(假定杂质不参加反应)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com