
| A. | 71g | B. | 71 | C. | 71g/mol | D. | 142g/mol |
科目:高中化学 来源: 题型:选择题
| A. | 2K+2H2O=2KOH+H2↑ | B. | Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3 | ||
| C. | 2Cu(NO3)2=2CuO+4NO2↑+O2↑ | D. | 3CO+Fe2O3=2Fe+3CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4 | B. | CO2+C$\frac{\underline{\;\;△\;\;}}{\;}$2CO | ||
| C. | NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O↑+CO2↑ | D. | CaCO3+CO2+H2O═Ca(HCO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
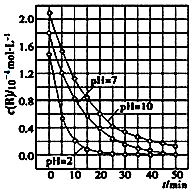 二氧化钛在一定波长光的照射下,可有效降解甲醛、苯等有机物,效果持久,且自身对人体无害.某课题组研究了溶液的酸碱性对TiO2光催化染料R降解反应的影响,结果如图所示.下列判断正确的是( )
二氧化钛在一定波长光的照射下,可有效降解甲醛、苯等有机物,效果持久,且自身对人体无害.某课题组研究了溶液的酸碱性对TiO2光催化染料R降解反应的影响,结果如图所示.下列判断正确的是( )| A. | 在0~50 min之间,R的降解百分率pH=2大于pH=7 | |
| B. | 溶液酸性越强,R的降解速率越大 | |
| C. | R的起始浓度不同,无法判断溶液的酸碱性对R的降解速率的影响 | |
| D. | 在20~25 min之间,pH=10时R的降解速率为04mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 2:1:1 | C. | 3:1:1 | D. | 1:2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
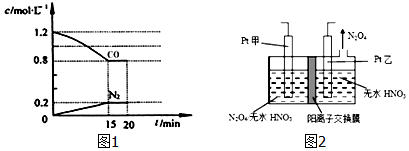
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 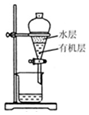 用如图装置分离有机 层与水层,水层从分液 漏斗下口放出 | |
| B. | 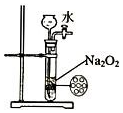 用如图装置可用来制 备少量氧气,并且控制 反应的发生与停止 | |
| C. | 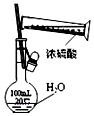 如图中配制一定物质的量浓度的硫酸溶液不能 直接在容量瓶中进行 | |
| D. | 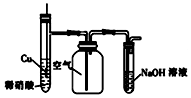 用如图装置制备并收集NO气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com