
 在理解概念的基础上,理清概念之间的相互关系,构建完整的知识体系是学习化学的重间的相互关系.中学化学常见晶体类型有:离子晶体如NaOH、KNO3等;
在理解概念的基础上,理清概念之间的相互关系,构建完整的知识体系是学习化学的重间的相互关系.中学化学常见晶体类型有:离子晶体如NaOH、KNO3等;| A | B | C | ||
| 晶体类别 | 分子晶体 | 原子晶体 | 金属晶体 | |
| 实例的化学式 | Na |
| 离子晶体 | ||
| (NH4)2S 或NH4HS | O2或O3 | Si |
| 离子晶体 | ||
| (NH4)2S 或NH4HS | O2或O3 | Si |
| ||
| ||


科目:高中化学 来源: 题型:
 中学常见物质A、B、C、D、E、X,存在如图转化关系(部分生成物和反应条件略去).下列推断不正确的是( )
中学常见物质A、B、C、D、E、X,存在如图转化关系(部分生成物和反应条件略去).下列推断不正确的是( )| A、若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁 |
| B、若D是一种强碱,则A、B、C均可与X反应生成D |
| C、若D为NaCl,且A可与C反应生成B,则E可能是CO2 |
| D、若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10ml 1.5mol/L AlCl3溶液 |
| B、100ml 1mol/L KCl溶液 |
| C、50ml 3mol/L NH4Cl溶液 |
| D、100ml 0.5mol/L MgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓硫酸 |
| △ |

| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| n(CO) | n(H2O) | n(H2) | n(CO2) | |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
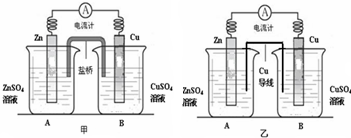
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硬脂酸甘油酯可用于制作肥皂 |
| B、乙二醇可用于配制汽车防冻液 |
| C、部分卤代烃可用作灭火剂 |
| D、甲醛的水溶液(福尔马林)可用于消毒自来水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com