
| A.离子化合物中都含有离子键 |
| B.离子化合物中的阳离子只能是金属离子 |
| C.离子化合物如能溶于水,其水溶液一定可以导电 |
| D.溶于水可以导电的化合物一定是离子化合物 |
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:不详 题型:单选题
| A.范德华力、范德华力、范德华力 |
| B.用范德华力、范德华力、共价键 |
| C.范德华力、共价键、共价键 |
| D.共价键、共价键、共价键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在水中的氢原子和氧原子有的以化学键结合,有的以氢键结合 |
| B.阴、阳离子之间除了有静电引力之外还有静电排斥力 |
| C.根据电离方程式:HCl====H+ + Cl- ,可判断HCl里存在离子键 |
| D.活泼金属元素与非金属元素之间可形成离子键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
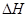 =-a kJ·mol-1 ② 2A → A-A;
=-a kJ·mol-1 ② 2A → A-A;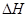 =-b kJ·mol-1
=-b kJ·mol-1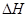 =-c kJ·mol-1
=-c kJ·mol-1 X(g);
X(g);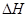 =-a KJ·mol-1(a>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
=-a KJ·mol-1(a>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2 mol A2、1 mol BC | 1 mol X | 4 mol A2、2 mol BC |
| 平衡时n(X) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | 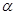 1 1 | 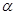 2 2 | 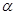 3 3 |
 ( A2)为 。
( A2)为 。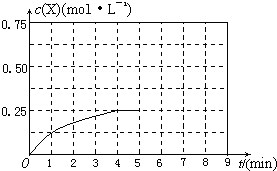
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碳原子的杂化类型发生了改变 |
| B.微粒的形状发生了改变 |
| C.微粒的稳定性发生了改变 |
| D.微粒中的键角发生了改变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①⑦ | B.①⑤⑦ | C.⑦ | D.②⑦ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 物质 | CH4 | C2H2 | H2 |
| 燃烧热/kJ/mol | 890.3 | 1299.6 | 285.8 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
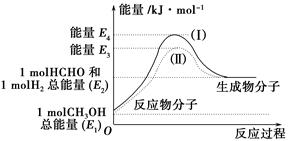
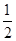 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
| A.CH3OH转变成H2的过程一定要吸收能量 |
| B.①反应中,反应物的总能量高于生成物的总能量 |
C.根据②推知反应:CH3OH(l)+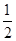 O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 |
| D.反应②的能量变化如图所示 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com