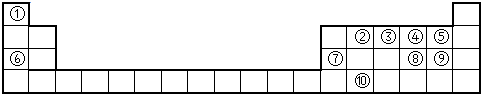
解:由元素在周期表中的位置可知,①为H,②为O,③为Al,④为F,⑤为Na,⑥为S,⑦为Cl,
(1)因电子层越多,半径越大,同周期元素从左向右原子半径在减小,F的半径最小,Na>Cl,所以原子半径为Na>Cl>F,故答案为:Na>Cl>F;
(2)非金属性Cl>S,则对应的最高价氧化物的酸性为HClO
4>H
2SO
4,故答案为:HClO
4;H
2SO
4;
(3)①、②两种元素的原子按1:1组成的常见液态化合物为H
2O
2,其电子式为
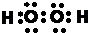
,具有氧化性,酸性溶液中该物质能将Fe
2+氧化为Fe
3+,该氯离子反应为H
2O
2+2Fe
2++2H
+=2Fe
3++2H
2O,
故答案为:
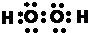
;H
2O
2+2Fe
2++2H
+=2Fe
3++2H
2O;
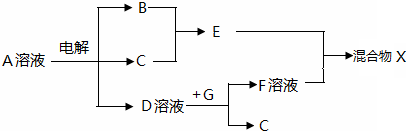
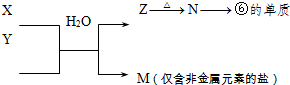
(4)B、C、G是单质,B为黄绿色气体,D溶液显碱性,则A为NaCl,B为Cl
2,C为H
2,D为NaOH,E为HCl,只有Al能与NaOH溶液反应生成氢气,
则G为Al,F为NaAlO
2,盐酸和偏铝酸钠反应可得到X,
①Al与NaOH溶液反应生成偏铝酸钠和氢气,该反应为2Al+2NaOH+2H
2O=2NaAlO
2+3H
2↑,
故答案为:2Al+2NaOH+2H
2O=2NaAlO
2+3H
2↑;
②因氯离子与银离子反应生成沉淀,则取少量A溶液滴加几滴(稀硝酸酸化的)硝酸银溶液有白色沉淀生成,
故答案为:取少量A溶液滴加几滴(稀硝酸酸化的)硝酸银溶液有白色沉淀生成;
③由溶液pH为12,则c(OH
-)=0.01mol/L,即n(NaOH)=0.01mol,由NaOH~e
-可知,则转移电子的物质的量为0.01mol,故答案为:0.01;
④由H
2O+HCl+NaAlO
2═NaCl+Al (OH)
3↓,则X中含有的物质为Al (OH)
3、H
2O、NaCl,
故答案为:Al (OH)
3、H
2O、NaCl.
分析:由元素在周期表中的位置可知,①为H,②为O,③为Al,④为F,⑤为Na,⑥为S,⑦为Cl,
(1)电子层越多,半径越大,同周期元素从左向右原子半径在减小;
(2)非金属性越强,对应的最高价氧化物的酸性越强;
(3)①、②两种元素的原子按1:1组成的常见液态化合物为 H
2O
2,具有氧化性;
(4)B、C、G是单质,B为黄绿色气体,D溶液显碱性,则A为NaCl,B为Cl
2,C为H
2,D为NaOH,E为HCl,只有Al能与NaOH溶液反应生成氢气,
则G为Al,F为NaAlO
2,盐酸和偏铝酸钠反应可得到X,
①Al与NaOH溶液反应生成偏铝酸钠和氢气;
②检验氯离子,可用硝酸和硝酸银;
③溶液pH为12可计算氢氧根离子的浓度,再利用电解反应计算转移电子;
④根据盐酸和偏铝酸钠反应来分析X中含有的物质.
点评:本题考查无机物的推断及元素在周期表中的位置,熟悉元素的位置及物质的性质是解答本题的关键,注意化学用语的使用来解答,难度不大.


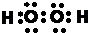 ,具有氧化性,酸性溶液中该物质能将Fe2+氧化为Fe3+,该氯离子反应为H2O2+2Fe2++2H+=2Fe3++2H2O,
,具有氧化性,酸性溶液中该物质能将Fe2+氧化为Fe3+,该氯离子反应为H2O2+2Fe2++2H+=2Fe3++2H2O,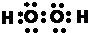 ;H2O2+2Fe2++2H+=2Fe3++2H2O;
;H2O2+2Fe2++2H+=2Fe3++2H2O;















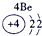



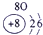

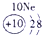






 表示的是
表示的是