
【题目】下列事实不能用平衡移动原理解释的是( )
A.铁触媒有利于合成氨反应
B.夏天开启啤酒瓶盖后,瓶中立刻泛起大量泡沫
C.对装有N2O4和NO2混合气体的密闭烧瓶加热,颜色变深
D.合成氨反应:![]()
![]()
![]() ,为使氨的产率提高,理论上应采取低温高压的措施
,为使氨的产率提高,理论上应采取低温高压的措施
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10 mol2·L-2,下列说法不正确的是( )

A.在t ℃时,AgBr的Ksp为4.9×10-13 mol2·L-2
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t ℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)的平衡常数K≈816
AgBr(s)+Cl-(aq)的平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl △H=+QkJ/mol(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行上述反应,下列叙述正确的是( )
Si(s)+4HCl △H=+QkJ/mol(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行上述反应,下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ
C.反应至4min时,若HCl浓度为0.12mol/L,则H2的反应速率为0.03mol/(L·min)
D.反应吸收0.025QkJ热量时,生成的HCl通入100mL1mol/L的NaOH溶液中恰好完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298K时,Ksp(NiS)=1.0×10-21,Ksp(FeS)=6.0× 10-18,其沉淀溶解平衡曲线如图所示(图中R表示Ni或Fe),下列说法正确的是(已知: ![]() ≈2.4,
≈2.4, ![]() ≈3.2) ( )
≈3.2) ( )
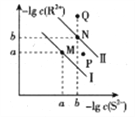
A. M点对应的溶液中,c(S2-)≈3.2×10-11 mol·L-1
B. 与P点相对应的NiS的分散系是均一稳定的
C. 向Q点对应的溶液中加水,可转化成N点对应的溶液
D. FeS+Ni2+![]() NiS+Fe2+的平衡常数K=6000
NiS+Fe2+的平衡常数K=6000
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在其他条件不变时,只改变某一条件,化学反应aA(g)+B(g)![]() cC(g)的平衡的变化图象如下(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率),据此分析下列说法正确的是
cC(g)的平衡的变化图象如下(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率),据此分析下列说法正确的是
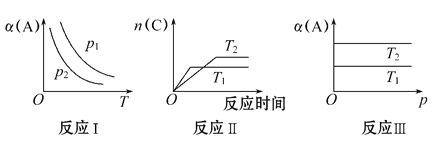
A. 在图象反应Ⅰ中,说明正反应为吸热反应
B. 在图象反应Ⅰ中,若p1>p2,则此反应的ΔS>0
C. 在图象反应Ⅱ中,说明该正反应为吸热反应
D. 在图象反应Ⅲ中,若T1>T2,则该反应能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】归纳法是髙中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:(均在常温下)
①pH=1的强酸溶液,加水稀释后,溶液中离子浓度都降低
②pH=2的盐酸和pH=l的盐酸,c(H+)之比为2:1
③pH相等的三种溶液:a.CH3COONa b.NaHCO3 c.NaOH,其溶质物质的量浓度由小到大顺序为:c、b、a
④反应2A(s)+B(g)=2C (g)+D(g)不能自发进行,则该反应△H一定大于0
⑤已知醋酸电离平衡常数为Ka:醋酸根水解常数为Kb;水的离子积为Kw:则三者关系为:KaKb=Kw
⑥反应A(g)=2B(g) △H,若正反应的活化能为EakJmol-1,逆反应的活化能为EbkJmol-1,则△H=(Ea-Eb)kJmol-1上述归纳正确的是( )
A.全部B.③④⑤⑥C.②④⑤⑥D.①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为用惰性电极电解CuCl2溶液,并验证其产物的实验装置,回答下问题:

(1)惰性电极Ⅰ为电解池的__________(选填“阴”或“阳”,下同)极。
(2)反应开始一段时间后,惰性电极Ⅰ上实验现象为______________________KI—淀粉溶液会变__________色。
(3)惰性电极Ⅱ上发生的电极反应为__________________________
(4)该电解反应方程式为____________________________________
(5)可以将惰性电极Ⅰ换为______________
A.铜棒 B.铁棒 C.钠块
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知pOH=-lgc(OH-)。T℃时,往50mL0.1mol·L-1MOH溶液中滴加0.1mol·L-1盐酸,溶液pH、pOH随滴入盐酸体积的变化如下图所示,以下说法正确的是
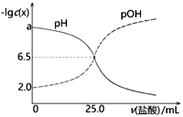
A. 盐酸与MOH溶液恰好中和时溶液pH=6.5
B. a=12
C. 盐酸滴定MOH实验中选择酚酞做指示剂比选甲基橙误差更小
D. T℃时,MOH的电离平衡常数Kb约为1.0×10-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实的解释合理且表达正确的是( )
A.NH4Cl溶液呈酸性:NH4++2H2O![]() NH3·H2O+H3O+
NH3·H2O+H3O+
B.氨气溶于水,溶液呈碱性:NH3·H2O=NH4++OH-
C.NaHSO4溶液可以导电:NaHSO4![]() Na++H++SO42-
Na++H++SO42-
D.常温下,饱和H2CO3溶液pH=4:H2CO3![]() 2H++CO32-
2H++CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com