
分析 (1)根据n=$\frac{m}{M}$计算CO、NO的物质的量之比,分子数目之比等于其物质的量之比,结合分子式计算含有氧原子数目之比,相同条件下,气体体积之比等于其物质的量之比;
(2)①根据质量与摩尔质量的关系计算出物质的量;
②根据阿伏伽德罗常数与离子数关系计算出该气体含有的原子数;
③根据标况下的气体摩尔体积计算出标况下mg气体的体积;
④1L水的质量约为1000g,据此计算出溶质的质量分数;
⑤根据c=$\frac{n}{V}$计算出该溶液的物质的量浓度.
解答 解:质量比为7:6的三种气体CO、NO物质的量之比为$\frac{7g}{28g/mol}$:$\frac{6g}{30g/mol}$=5:4,故分子数目之比为5:4:4,含有氧原子数目之比为5×1:4×1=5:4,相同条件下,气体体积之比等于其物质的量之比,则体积之比为5:4,
故答案为:5:4;5:4;5:4;
(1)mg该气体的物质的量为:n=$\frac{m}{M}$mol,故答案为:$\frac{m}{M}$;
(2)含有原子的物质的量为=$\frac{m}{M}$mol×2=$\frac{2m}{M}$mol,该气体所含原子总数为:N=$\frac{2m}{M}$mol×NA=$\frac{2m{N}_{A}}{M}$,故答案为:$\frac{2m{N}_{A}}{M}$;
(3)mg该气体在标准状况下的体积为:V=n×22.4L/mol=22.4L/mol×$\frac{m}{M}$mol=$\frac{22.4m}{M}$L,故答案为:$\frac{22.4m}{M}$;
(4)该气体溶于1L水中(不考虑反应),1L水的质量约为1000g,则该溶液中溶质的质量分数为:ω=$\frac{m}{m+1000}$×100%=$\frac{100m}{m+1000}$%,故答案为:$\frac{100m}{m+1000}$;
(5)该气体溶于水后形成V L溶液,其溶液中溶质的物质的量浓度为:c=$\frac{n}{V}$=$\frac{\frac{m}{M}}{V}$mol/L=$\frac{m}{MV}$mol/L,故答案为:$\frac{m}{MV}$.
点评 本题考查了有关物质的量的简单计算,题目难度中等,注意掌握物质的量与阿伏伽德罗常数、气体摩尔体积、摩尔质量等物理量之间的转化关系.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 获得新核素${\;}_{113}^{278}$Ja的过程,是一个化学变化 | |
| B. | 题中涉及的三种元素,都属于金属元素 | |
| C. | 这种超重核素${\;}_{113}^{278}$Ja的中子数与质子数只差为52 | |
| D. | 这种新核素,是同主族元素中原子半径最大的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
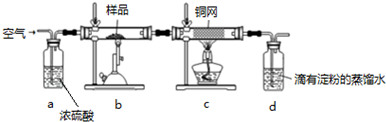
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 .下列关于靛蓝的叙述中错误的是( )
.下列关于靛蓝的叙述中错误的是( )| A. | 靛蓝由碳、氢、氧、氮四种元素组成 | B. | 它的分子式是C16H10N2O2 | ||
| C. | 该物质属于烃 | D. | 它是不饱和的有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
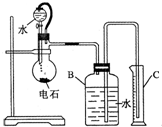 某同学设计如图所示的实验装置来粗略测定电石中碳化钙的质量分数.
某同学设计如图所示的实验装置来粗略测定电石中碳化钙的质量分数.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
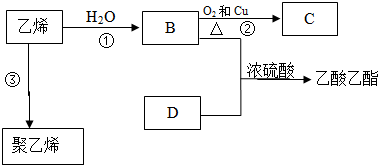
 .
. ,反应类型:加聚反应.
,反应类型:加聚反应. 
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂是为了加快反应速率,提高生产效率 | |
| B. | 通过调控反应条件,SO2可以100%地转化为SO3 | |
| C. | SO2的浓度与SO3的浓度相等时,反应达到平衡 | |
| D. | 因为反应放热,所以升高温度会使反应速率减慢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com