
| A. | 用水鉴别乙醇、苯和四氯化碳 | |
| B. | 用酸性高锰酸钾溶液鉴别苯、己烯和己烷 | |
| C. | 用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 | |
| D. | 用燃烧法鉴别甲烷、乙烯和乙炔 |
分析 A.乙醇易溶于水,苯、四氯化碳不溶于水,二者密度不同;
B.苯和己烷与高锰酸钾都不反应;
C.乙醇易溶于水,乙酸与碳酸钠溶液反应,乙酸乙酯不溶于饱和碳酸钠溶液;
D.含碳量不同,燃烧时现象不同.
解答 解:A.乙醇易溶于水,苯、四氯化碳不溶于水,苯的密度比水小,四氯化碳的密度比水大,可鉴别,故A正确;
B.苯和己烷与高锰酸钾都不反应,不能鉴别,故B错误;
C.乙醇易溶于水,乙酸与碳酸钠溶液反应生成气体,乙酸乙酯不溶于饱和碳酸钠溶液,可鉴别,故C正确;
D.含碳量不同,燃烧时现象不同,甲烷燃烧有淡蓝色火焰,乙烯火焰较明亮,乙炔燃烧火焰明亮,有黑烟,可鉴别,故D正确.
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应及鉴别方法等为解答的关键,侧重分析与应用能力的考查,注意有机物的性质应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe与盐酸反应 2Fe+6H+═2Fe3++3H2↑ | |
| B. | 碳酸钙与醋酸反应 CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O | |
| C. | 氯气与H2O反应 Cl2+H2O═Cl-+2H++ClO- | |
| D. | 过量的CO2与Ca(ClO)2溶液反应:CO2+ClO-+H2O═HClO+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
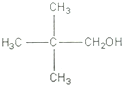
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
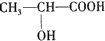 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 手机上用的锂离子电池属于二次电池 | |
| B. | 铜-锌-稀硫酸电池工作时,当转移2mol电子时,正极区可生成氢气2.24L | |
| C. | 氢氧燃料电池可把化学能转为电能 | |
| D. | 锌锰电池、镍镉电池、化学电池易造成环境污染,而氢氧燃料电池是对环境友好的电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com