
【题目】将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度/10-3 mol·L-1 | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.该可逆反应达到平衡的标志之一是混合气体平均相对分子质量不变
B.因该反应熵变(ΔS)大于0,焓变(ΔH)大于0,所以在低温下自发进行
C.根据表中数据,计算15.0 ℃时的分解平衡常数约为2.0×10-9
D.达到平衡后,若在恒温下压缩容器体积,氨基甲酸铵固体的质量减小
【答案】C
【解析】本题考查平衡状态的判断、平衡常数的计算、平衡移动的影响因素。A错误,根据题给化学方程式可知:生成的气体的物质的量之比始终是2∶1,所以气体的平均相对分子质量始终不变,故不能作为平衡状态的判断依据;B错误,从表中数据可以看出,随着温度升高,气体的总浓度增大,平衡正向移动,则该反应为吸热反应,ΔH>0;反应中固体变为气体,混乱度增大,ΔS>0,根据ΔG=ΔH-TΔS可知反应在高温下自发进行;C正确,反应中生成的氨和二氧化碳的浓度之比为2∶1,总浓度为2.4×103 mol·L-1,所以氨的浓度为1.6×103 mol·L-1,二氧化碳的浓度为8.0×104 mol·L-1,所以平衡常数K=(1.6×103)2×8.0×104=2.0×109;D错误,压缩容器体积,气体压强增大,平衡向逆向移动,氨基甲酸铵质量增加。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】2.4g Mg与100mL稀硫酸完全反应,反应前后溶液体积变化忽略不计.
求:(1)产生的气体在标准状况下的体积.
(2)反应完全后,所得溶液中镁离子的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小李在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连环物质间不能发生反应。你认为“五连环”中物质间发生的反应没有涉及的基本反应类型是
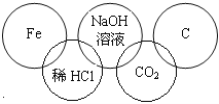
A. 复分解反应 B. 分解反应
C. 化合反应 D. 置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌与稀硫酸反应,下列说法错误的是( )
A. 加热可加快反应速率 B. 增大稀硫酸的浓度可加快反应速率
C. 粉碎锌粒可加快反应速率 D. 提高锌的纯度可加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2017天津]根据元素周期表和元素周期律,判断下列叙述不正确的是

A.气态氢化物的稳定性:H2O>NH3>SiH4
B.氢元素与其他元素可形成共价化合物或离子化合物
C.图1所示实验可证明元素的非金属性:Cl>C>Si
D.用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A.甲烷和乙烯都可以与氯气反应
B.酸性高锰酸钾可以氧化苯和甲苯
C.乙烯可以与氢气发生加成反应,苯不能与氢气加成
D.溴乙烷在NaOH的醇溶液中充分反应可得到乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 64gCaC2中含有的共用电子对数为3NA
B. 常温常压下,1.8g甲基(-CD3)中含有的中子数为NA
C. 1.5mol的MnO2粉末与足量浓盐酸共热转移电子数目小于3NA
D. 1L0.01 mol L-1KA1(SO4)2溶液中含有的阳离子数为0.02NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com