
硼是一种重要的非金属元素,单质硼可以通过硼镁矿(主要成分为Mg2B2O5·H2O)来制取。
第①步:将硼镁矿用NaOH浓溶液溶解,过滤得NaBO2溶液
第②步:将NaBO2 浓缩后通入CO2调节碱度,结晶析出硼砂Na2B4O7·10H2O
第③步:将硼砂溶于水后,用H2SO4调节碱度,过滤得H3BO3 晶体
第④步:加热硼酸使之脱水生成B2O3。
第⑤步:B2O3用镁还原即得粗单质硼。
请回答下列问题:
(1)已知H3BO3 分子中只含B—O键和O—H键,则H3BO3 的结构式为___________。
(2)第①步反应的化学方程式为_______________________________________;
第③步反应的离子方程式为____________________________________________。
(3)制得的粗硼在一定条件下反应全部化成BI3,然后BI3热分解可以得到纯净的单质硼。由0.25g粗硼制成的BI3分解得到I2全部被收集后,用1.80mol·L-1的Na2S2O3溶液滴定,用去35.00mLNa2S2O3溶液(已知:I2+2S2O32-=2I-+S4O52-)
①盛装Na2S2O3溶液的为____________(填“酸式”或“碱式”)滴定管,滴定过程中所用的指示剂为________________。
②粗硼中硼的含量为__ ________________。
________________。
【知识点】化学方程式的书写;盐类水解的原理
【答案解析】.(1)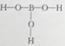 (1分)
(1分)
(2)Mg2B2O5·H2O+2NaOH=2NaBO2+2Mg(OH)2↓;B4O72-+2H++5H2O=4H3BO3↓(各2分)(3)①碱式;淀粉溶液(各1分)②92.4%(2分)
解析:(1)根据原子成键理论可知在分子结构中B原子能形成三个共价键,氧原子能形成两个共价键,可以得到此H3BO3 的结构式为 。
。
(2)第①步为Mg2B2O5•H2O与氢氧化钠溶液反应,反应的化学方程式为:Mg2B2O5•H2O+2NaOH=2NaBO2+2Mg(OH)2↓;第③步为生成的硼砂和加入的硫酸反应生成H3BO3 晶体,故反应的化学方程式为:B4O72-+2H++5H2O=4H3BO3↓
(3)①Na2S2O3溶液中S2O32-离子水解溶液显示碱性,故应选用碱式滴定管;滴定过程中有碘单质参与,可以使用淀粉溶液作为指示剂;②硫代硫酸钠的物质的量为:1.8mol/L×35.00mL =0.063mol,根据关系式:B~BI3~3/2I2~3S2O32-,n(B)=1/3n(S2O32-)=0.021mol,m(B)=0.231g,则粗硼中硼的含量为92.4%。
【思路点拨】本题考查了硼元素的基本性质,陌生化学方程式的书写,抓住本题提供的信息得到结论是解答本题的关键,考查了学生的知识的综合运用能力,题目难度稍大。


科目:高中化学 来源: 题型:
室温下,在pH=12的某溶液中,由水电离的c(OH-)为( )
A.1.0×10-7 mol/L
B.1.0×10-6 mol/L
C.1.0×10-4 mol/L
D.1.0×10-12 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
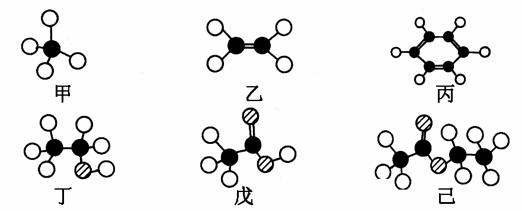
下图是六种常见有机化合物分子的球棍模型,下列有关叙述中不正确的是
A.甲、乙、丙属于烃,丁、戊、己属于烃的衍生物
B.丙和己混合后会分层,且丙在上层
C.甲、丙、丁、戊、己均发生取代反应
D.乙和水反应可生成丁,丁和戊反应可生成己
查看答案和解析>>
科目:高中化学 来源: 题型:
用某种酸处理高岭石时,会得到一种沉淀,该沉淀由X、Y、Z、W四种短周期元素组成,它的化学式为XYZW6,其中X、Y、Z位于同一周期且最外层电子数依次增大,Y2+与W-具有相同电子层结构,下列说法正确的是
A. 离子半径:Y2+>W- B. 原子半径:X>Y>Z>W
C. 单质沸点:X>Y>Z>W D.四种元素的简单离子均能破坏水的电离平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
中国环境监测总站数据显示,颗粒物(PM2.5)是连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx 等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断PM2.5的酸碱性为试样的pH=______。
(2)NOx 汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
则反应N2(g)+O2(g) 2NO(g)
2NO(g) 
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
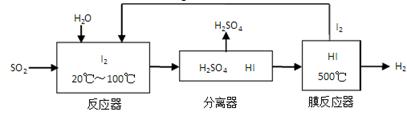
①用离子方程式表示反应器中发生的反应:__________________________。
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是_______。
③用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池。电池充放电时的总反应为:NiO(OH)2+M NiO(OH)+MH,电池放电时,负极的电极反应式________________________________;充电完成时,Ni(OH)2全部转化为NiO(OH),若继续充
NiO(OH)+MH,电池放电时,负极的电极反应式________________________________;充电完成时,Ni(OH)2全部转化为NiO(OH),若继续充 电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电池反应式为______________。
电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电池反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质相互混合反应后 ,最终有白色沉淀生成的是
,最终有白色沉淀生成的是
①金属钠投入到FeC12溶液中 ②过量NaOH溶液和明矾溶液馄合 ③少量Ca (OH)2投入过量NaHCO3溶液中 ④向NaAlO2溶液中通入过量CO2 ⑤向饱和Na2CO3溶液中通入过量CO2
A.①②③④⑤ B.只有①④ C.只有②③ D.只有③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作或结论正确的是
A.配制一定物质的量浓度的溶液时,容量瓶必须洁净、干燥,不漏水
B.实验室里需要480 mL 2.0 moI·L-1氢氧化钠溶 液,配制溶液时先称量氢氧化钠固38.4 g,然后再按照溶解、冷却、洗涤、定容、摇匀的步骤进行操作
液,配制溶液时先称量氢氧化钠固38.4 g,然后再按照溶解、冷却、洗涤、定容、摇匀的步骤进行操作
C. 25℃时,用惰性电极电解某浓度的NaOH溶液,一小段时间后,NaOH溶液的浓度可能增大,也可能不变
D . K2CO3在酒精灯上灼烧时能直接观察到紫色火焰
. K2CO3在酒精灯上灼烧时能直接观察到紫色火焰
查看答案和解析>>
科目:高中化学 来源: 题型:
某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1mol/L(此数值忽略水的电离及离子的水解)。
| 阳离子 | K+ Ag+ Mg2+ Cu2+ Al3+ |
| 阴离子 | C1- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ、取该无色溶液5 mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ、用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ、另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅳ、向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由I、Ⅱ判断,溶液中一定不含有的阳离子是 。
(2)Ⅲ中加入盐酸生成无色气体的离子方程式是 。
(3)甲同学最终确定原溶液中所含阳离子有 ,阴离子有 ;并据此推测原溶液应该呈 性,原因是 (请用离子方程式说明)。
(4)另取100 mL原溶液,加入足量的NaOH溶液,此过程中涉及的离子方程式为
。充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
100 mL浓度为2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )
A.加入适量6 mol·L-1的盐酸 B.加入少量醋酸钠固体
C.加热 D.加入少量金属钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com