
25 ℃时,20.00 mL硫酸和硝酸的混合溶液,加入足量的氯化钡溶液,充分反应后过滤、洗涤、烘干,可得0.466 g沉淀。滤液跟2 mol/L NaOH溶液反应,用去10.00 mL碱液时恰好中和。下列说法中正确的是( )
A.原混合液中c(SO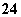 )=0.2 mol/L B.原混合液中c(NO
)=0.2 mol/L B.原混合液中c(NO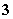 )=0.9 mol/L
)=0.9 mol/L
C.原混合液中pH=0 D.原混合液中由水电离出的c(H+)=0.1 mol/L
【答案】C
【解析】由题意可知0.466g沉淀为BaSO4 ,n(BaSO4 )=0.466/233=0.002mol,n(H2SO4 )=0.002mol,滤液跟2mol/lNaOH溶液反应,共用去10.00ml碱液时恰好中和,则由反应H++OH-=H2O可知,n(H+)=n(NaOH)=0.01L×2mol/L=0.02mol,则n(HNO3 )=0.02mol-2×0.002mol=0.016mol,
则c(SO42-)=0.002/0.02=0.1mol/L,c(NO3-)=0.016/0.02=0.8mol/L,n(H+)=0.02/0.02=1mol/L,
pH=0,原混合液中由水电离出的c(H+)=1×10-14mol/L,选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
已知:SO2(g)+1/2O2(g)⇌SO3(g)△H=﹣98kJ•mol﹣1.
(1)某温度下该反应的平衡常数K=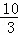 ,若在此温度下,向100L的恒容密闭容器中,充入3.0mol SO2(g)、16.0mol O2(g)和3.0mol SO3(g),则反应开始时v(正) v(逆)(填“<”、“>”或“=”).
,若在此温度下,向100L的恒容密闭容器中,充入3.0mol SO2(g)、16.0mol O2(g)和3.0mol SO3(g),则反应开始时v(正) v(逆)(填“<”、“>”或“=”).
(2)一定温度下,向一带活塞的体积为2L的密闭容器中充入2.0mol SO2和1.0mol O2,达到平衡后体积变为1.6L,则SO2的平衡转化率为 .
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是 (填字母).
A.保持温度和容器体积不变,充入1.0mol O2
B.保持温度和容器内压强不变,充入1.0mol SO3
C.降低温度
D.移动活塞压缩气体
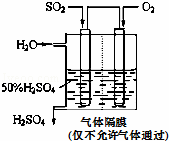
(4)若以如图所示装置,用电化学原理生产硫酸,写出通入O2电极的电极反应式为 .
(5)为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
A.用物质A表示的反应平均速率为0.3 mol·L-1·s-1
B.用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
C.2 s时物质A的转化率为70%
D.2 s时物质B的浓度为0.7 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,100 mL 0.01 mol·L-1的醋酸溶液与10 mL 0.1 mol·L-1的醋酸溶液相比较,下列数值前者大于后者的是( )
A.c(OH-) B.c(H+) C.中和时所需NaOH的量 D.c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度时于密封容器中发生反应:mA(g)+nB(g)  pC(g),达平衡后,若将气体体积扩大到原来的2倍。再达平衡时A的浓度是原来的0.8倍,则下列叙述正确的是( )
pC(g),达平衡后,若将气体体积扩大到原来的2倍。再达平衡时A的浓度是原来的0.8倍,则下列叙述正确的是( )
A.平衡向正向移动 B.新平衡时,v正(A)=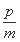 v逆(C)
v逆(C)
C.气体A的转化率升高 D.m+n>p
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,取0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
(1)混合溶液中由水电离出的c (H+) 0.2 mol·L-1 HCl溶液中由水电离出的c (H+) (填“>、<或=”)。
(2)求出混合物中下列算式的精确计算结果(填具体数字):
c (Cl-) − c (M+)= mol·L-1,c (H+) − c (MOH) = mol·L-1 。
(3)若常温下取0.2 mol·L-1 MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,说明MOH的电离程度 (填“>、<或=”)MCl的水解程度。溶液中各离子浓度由大到小的顺序为 。
(4)若常温下pH=3的盐酸与pH=11的氨水溶液等体积混合,则混合溶液的pH 7(填“>、<或=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关反应原理及其应用,不正确的是( )
A.苯与浓硝酸反应;制备TNT炸药
B.葡萄糖能与新制Cu(OH)2悬浊液反应;尿糖检测
C.醋酸能与CaCO3、Mg(OH)2等反应;用食醋除去暖瓶中的水垢
D.乙烯能与水反应生成乙醇;制取工业酒精
查看答案和解析>>
科目:高中化学 来源: 题型:
通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%。
(1)X的分子式是____________;
(2)X与金属钠反应放出氢气,反应的化学方程式是__________________________(有机物用结构简式表示);
(3)X与空气中的氧气在铜或银催化下反应生成Y,Y的结构简式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下, 相同pH的盐酸和醋酸溶液分别加水稀释, pH 随溶液体积变化的曲线如图所示。据右图判断正确的是
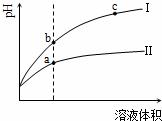
A.Ⅱ为盐酸稀释时的pH变化曲线
B.a点KW的数值比c点KW的数值大
C.b点溶液的导电性比c点溶液的导电性强
D.b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com