

分析 废铁屑中含有酯类油污,Na2CO3为强碱弱酸盐,CO32-水解生成HCO3-和OH-,升高促进CO32-水解,碱促进油脂水解,然后过滤洗涤,加入稀硫酸,发生反应II为Fe+H2SO4=FeSO4+H2↑,趁热过滤、冷却结晶,过滤洗涤得到FeSO4•7H2O;
硫酸亚铁溶液加入过氧化氢氧化为硫酸铁溶液,加热蒸发部分溶剂,加入热浓分硫酸铵溶液,保温80℃,可生成硫酸铁铵,经冷却结晶、过滤洗涤,最后经常温晾晒可到纯净的硫酸铁铵,据此分析解答.
解答 解:(1)Na2CO3为强碱弱酸盐,CO32-水解生成HCO3-和OH-,水解方程式为CO32-+H2O?HCO3-+OH-,油脂在碱性条件下水解生成可溶于水的酸和醇;
盐的水解为吸热反应,升温,促进水解,溶液碱性增强,使反应充分进行;
故答案为:CO32-+H2O?HCO3-+OH-;升温,促进水解,溶液碱性增强,使反应充分进行;
(2)废铁屑中含氧化铁,无需在制备前除去,因为氧化铁和酸反应生成铁盐,铁盐能被Fe还原生成亚铁盐,涉及的离子方程式为Fe2O3+6H+═2Fe3++3H2O、2Fe3++Fe═3Fe2+,铁屑不再溶解,铁屑表面不再有气泡产生,反应Ⅱ完全反应;
故答案为:Fe2O3+6H+═2Fe3++3H2O,2Fe3++Fe═3Fe2+;铁屑不再溶解,铁屑表面不再有气泡产生;
(3)氧化剂X氧化亚铁离子,同时不引入新杂质,故选则过氧化氢;
故答案为:b;
(4)亚铁离子用铁氰化钾检验,氧化亚铁时加入的过氧化氢过量,过氧化氢也能使酸性高锰酸钾褪色,故不选酸性高锰酸钾;
故答案为:铁氰化钾溶液;不能,因为H2O2和Fe2+均能使酸性的KMnO4溶液褪色;
(5)硫酸铁铵溶液经冷却结晶、过滤洗涤,最后经常温晾晒可到纯净的硫酸铁铵,操作①冷却结晶;检验铵根离子的方法为:在试管中加入少量样品和NaOH固体加热,在试管口用湿润的红色石蕊试纸检验,看到试纸变成蓝色;
故答案为:冷却结晶;试管中加入少量样品和NaOH固体加热,在试管口用湿润的红色石蕊试纸检验,看到试纸变成蓝色;
(6)称取14.00g样品,将其溶于水配置成100mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14g沉淀,应为Fe(OH)3,
n(Fe(OH)3)=$\frac{2.14g}{107g/mol}$=0.02mol,
向另一份溶液中加入0.05mol Ba(NO3)2溶液,恰好完全反应,则n(SO42-)=0.05mol,
所以14.00g样品中含有Fe2(SO4)30.02mol,n(SO42-)为0.1mol,则(NH4)2SO4为0.1mol-0.02mol×3=0.04mol,
则m(H2O)=14.00g-0.02mol×400g/mol-0.04mol×132g/mol=0.72g,
n(H2O)=$\frac{0.72g}{18g/mol}$=0.04mol,
n(Fe2(SO4)3):n((NH4)2SO4):n(H2O)=0.02:0.04:0.04=1:2:2,
所以化学式为Fe2(SO4)3•2(NH4)2SO4•2H2O或(NH4)4Fe2(SO4)5•2H2O;
故答案为:Fe2(SO4)3•2(NH4)2SO4•2H2O或(NH4)4Fe2(SO4)5•2H2O.
点评 本题考查考查物质的制备、分离提纯、物质组成的测定,为高考常见题型,明确实验目的、实验原理为解答关键,注意掌握物质分离与提纯方法,试题侧重考查学生的分析、理解能力及计算能力.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
下列关于热化学反应的描述中正确的是
A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为2×(-57.3)kJ/mol
B.500℃、30MPa 下,将0.5molN2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)
下,将0.5molN2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g) △H=-38.6kJ·m
2NH3(g) △H=-38.6kJ·m ol-1
ol-1
C.CO(g)的燃烧热是283.0 kJ/mol,则表示CO燃烧热的热化学方程式为CO(g)+1/2O2(g)=CO2 (g);△H=-283.0 kJ/mol
D.需要加热才能发生的反应一定是吸热反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西西藏民族学院附中高二上月考二化学卷(解析版) 题型:填空题
Ⅰ在某一容积为5 L的密闭容器内,加入 0.2 mol的CO和0.2 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如
CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如 下图:
下图: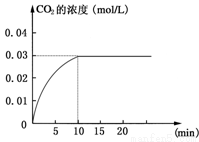
(1)根据上图数据,反应开始至达到平衡时,CO的化学反应速率为v(CO)= mol/(L·min);反应达平衡时,c(H2)=________ mol/L,该温度下的平衡常数K 。
(2) 判断该反应达到平衡的依据是________________。
① CO减少的化学反应速率和CO2减少的化学反应速率相等
② CO、H2O、CO2、H2的浓度都相等
③ CO、H2O、CO2、H2的浓度都不再发生变化
④ 正、逆反应速率都为零
(3)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.1 mol的CO2和0.1 mol的H2,在相同的条件下,反应达平衡时,c(H2O)=_____________mol/L。
Ⅱ、在含有I-、Cl-的混合溶液中,逐滴加入一定量AgNO3溶液,当AgCl开始沉淀时,溶液中 为:___________,已知Ksp(
为:___________,已知Ksp( AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西西藏民族学院附中高二上月考二化学卷(解析版) 题型:选择题
某金属能和盐酸反应生成氢气,与锌组成原电池时,锌为负极,则该金属可能为( )
A.铝 B.铜 C.锡 D.硅
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西西藏民族学院附中高二上月考二化学卷(解析版) 题型:选择题
在2L密闭容器内,某气体反应物在2s内由8mol变为7.2mol,则该反应的平均反应速率为( )
A. 0.2mol/(L·s) B. 0.3mol/(L·s) C. 0.1mol/(L·s) D. 0.4mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究氧化物与悬浮在大气中的海盐粒子的相互作用时,设计如下反应:
研究氧化物与悬浮在大气中的海盐粒子的相互作用时,设计如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 装置 | 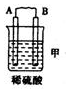 | 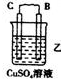 |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2、HClO、SO2等物质都具有漂白作用 | |
| B. | 纯碱和小苏打都是碱 | |
| C. | 所有的置换反应都是氧化还原反应,而所有的复分解反应都是非氧化还原反应 | |
| D. | 非金属氧化物不一定是酸性氧化物,有些金属氧化物也能与强碱反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com