
完成下列反应的离子方程式:
(1)氢氧化铁溶于氢碘酸:
(2)苯酚钠溶液中通入![]() 气体:
气体:
(3)氢氧化亚铁溶于稀![]() :
:
(4)已知H+比Ag+更易与NH3结合,要使[Ag(NH3)2]+转化为Ag+,应加入的有效试剂是 ,实现此反应的离子方程式为: 。
(5)① 在淀粉碘化钾溶液中,滴加少量的次氯酸钠溶液,立即会看到溶液变蓝色,这是因为: 。
② 在碘和淀粉形成的蓝色溶液中,滴加亚硫酸钠溶液,发现蓝色逐渐消失,这是因为: 。
③ 对比①和②所得的实验结果,将I2、ClO-、SO42-按氧化性强弱顺序排列为:
。
科目:高中化学 来源: 题型:阅读理解
| 实验步骤 | 实验现象 | 实验结论(步骤2用离子方程式表示) |
| 1.取食盐少许于一支试管中,加入适量的蒸馏水,振荡. | 固体完全溶解 | 食盐及碘酸钾都能溶于水 |
| 2.向上述溶液中滴加适量的亚硫酸氢钠溶液,振荡 | 溶液出现棕黄色 | 2IO3-+5HSO3-═I2+5SO42-+3H++H2O 2IO3-+5HSO3-═I2+5SO42-+3H++H2O |
| 3. 再向上述溶液中滴加淀粉溶液,振荡 再向上述溶液中滴加淀粉溶液,振荡 |
溶液变成蓝色 | 淀粉遇碘变蓝 淀粉遇碘变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 0.085cV |
| ρ |
| 0.085cV |
| ρ |
| 实 验 内 容 | 实 验 方 法 | 实 验 现 象 |
| 探究氧化性 | 取适量饱和硫化氢溶液于试管中,滴入 过氧化氢溶液.(取适量碘化钾淀粉溶液于试管中,加入过氧化氢溶液.) 取适量饱和硫化氢溶液于试管中,滴入 过氧化氢溶液.(取适量碘化钾淀粉溶液于试管中,加入过氧化氢溶液.) |
产生淡黄色沉淀或溶液变浑浊.(溶液变蓝色.) 产生淡黄色沉淀或溶液变浑浊.(溶液变蓝色.) |
| 或探究不稳定性 | 取适量过氧化氢溶液于试管中,加热, 用带火星的木条检验.(取适量过氧化氢溶液于试管中,加热,用导气管将得到的气体通入到装有饱和硫化氢溶液的试管中.) 取适量过氧化氢溶液于试管中,加热, 用带火星的木条检验.(取适量过氧化氢溶液于试管中,加热,用导气管将得到的气体通入到装有饱和硫化氢溶液的试管中.) |
产生气泡,木条复燃.(溶液变浑浊或有浅黄色沉淀产生) 产生气泡,木条复燃.(溶液变浑浊或有浅黄色沉淀产生) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验步骤 | 实验现象 | 实验结论(步骤2用离子方程式表示) |
| 1.取食盐少许于一支试管中,加入适量的蒸馏水,振荡. | 固体完全溶解 | 食盐及碘酸钾都能溶于水 |
| 2.向上述溶液中滴加适量的亚硫酸氢钠溶液,振荡. | 溶液出现棕黄色 | 2IO3-+5HSO3-═I2+5SO42-+3H++H2O 2IO3-+5HSO3-═I2+5SO42-+3H++H2O |
| 3.再向上述溶液中滴加淀粉溶液,振荡. | 溶液变成蓝色 | 淀粉遇碘变蓝 淀粉遇碘变蓝 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

完成下列问题:
(1)A中发生反应的离子方程式:______________________、___________________________,?B导管产生的气体是________________。
(2)A中反应速率比同浓度盐酸与纯铁反应要快,其原因是__________________________。
(3)烧杯内稀硝酸过量的目的是_________________________________________________。
(4)a在实验过程中都必须打开,除为了排除产生的气体外,另一目的是_________________。
(5)用降温结晶的方法制FeCl3·6H2O晶体,而不能直接蒸干制得晶体的原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
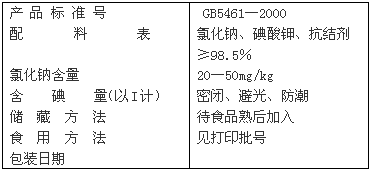
(1)加碘食盐的包装袋上通常标有如下食用建议:勿长时间炖炒。其中包含的原理是____________________________________________________________________。
(2)KIO3可用电解的方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定温度和电流下电解KI溶液。总反应方程式为:KI+3H2O![]() KIO3+3H2↑,则两极的电极反应式分别为:阴极____________,阳极______________。
KIO3+3H2↑,则两极的电极反应式分别为:阴极____________,阳极______________。
(3)为检验某食盐中是否含有KIO3,某同学取食盐样品428 g完全溶解于水中,然后加入用盐酸酸化的淀粉KI溶液,结果溶液呈蓝色,则反应的离子方程式为______________。为进一步确定该样品是否为合格产品,该同学又用0.030 mol·L-1的Na2S2O3溶液滴定,当用去18.00 mL时蓝色刚好褪去(反应离子方程式为:I2+![]() ====2I-+
====2I-+![]() ),由此可判定该加碘食盐为_______ (填“合格”或“不合格”)产品。
),由此可判定该加碘食盐为_______ (填“合格”或“不合格”)产品。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com