
分析 (1)碳酸钙和盐酸反应生成氯化钙和水、二氧化碳;
(2)氢氧化钡溶液和稀硫酸反应生成硫酸钡和水;
(3)碳酸氢钠为强电解质,完全电离;
(4)H++OH-=H2O表示强酸与强碱反应生成可溶性盐和水;
(5)CO32-+2H+=CO2↑+H2O可表示可溶性碳酸盐和强酸反应,生成可溶性盐和水、二氧化碳;
(6)氧化铁与盐酸反应生成氯化铁和水;氯化铁与氨水反应生成氢氧化铁和氯化铵.
解答 解:(1)碳酸钙和盐酸反应生成氯化钙和水、二氧化碳,离子方程式:CaCO3+2H+=Ca2++CO2↑+H2O;
故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;
(2)氢氧化钡溶液和稀硫酸反应生成硫酸钡和水,离子方程式:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;
故答案为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;
(3)碳酸氢钠为强电解质,完全电离,电离方程式:NaHCO3=Na++HCO3-;
故答案为:NaHCO3=Na++HCO3-;
(4)H++OH-=H2O表示强酸与强碱反应生成可溶性盐和水,可以表示盐酸与氢氧化钠反应,方程式:
NaOH+HCl=NaCl+H2O;
故答案为:NaOH+HCl=NaCl+H2O;
(5)CO32-+2H+=CO2↑+H2O可表示可溶性碳酸盐和强酸反应,生成可溶性盐和水、二氧化碳,可以表示碳酸钠与盐酸反应,方程式:Na2CO3+2HCl=2NaCl+CO2↑+H2O;
故答案为:Na2CO3+2HCl=2NaCl+CO2↑+H2O;
(6)氧化铁与盐酸反应生成氯化铁和水,离子方程式:Fe2O3+6H+=2Fe3++3H2O;氯化铁与氨水反应生成氢氧化铁和氯化铵,离子方程式:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+;
故答案为:Fe2O3+6H+=2Fe3++3H2O;Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.
点评 本题考查了离子方程式的书写,电解质电离方程式的书写,明确反应实质及物质的性质是解题关键,注意离子反应遵循客观事实,题目难度不大.


科目:高中化学 来源: 题型:解答题
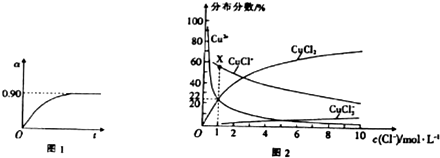
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲溶液含有OH- | B. | 乙溶液含有SO42- | C. | 丙溶液含有Cl- | D. | 丁溶液含有Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用A表示的反应速率是0.4 mol•L-1•min-1 | |
| B. | 分别用B、C、D表示的反应速率之比是3:2:1 | |
| C. | 在2 min末的反应速率,用B表示是0.3 mol•L-1•min-1 | |
| D. | 在2 min内的反应速率,用C表示是0.3 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
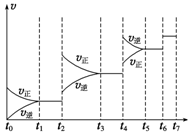 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.| t1~t2 | t3~t4 | t5~t6 | t6~t7 |
| K1 | K2 | K3 | K4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L水中溶解了40 g NaOH后,所得溶液浓度为1 mol/L | |
| B. | 从1 L 2 mol/L的NaCl溶液中取出0.5 L,该溶液的浓度为1 mol/L | |
| C. | 将2.24 L(标准状况)HCl气体溶于水制成100 mL溶液,其物质的量浓度为1 mol/L | |
| D. | 配制1 L 0.2 mol/L的CuSO4溶液,需用32g胆矾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸与水能以任意比互溶 | B. | 醋酸溶液能导电 | ||
| C. | 醋酸溶液中存在醋酸分子 | D. | 醋酸能和碳酸钙反应放出CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④① | B. | ④①②③ | C. | ①④②③ | D. | ③②①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com