
·ÖĪö £Ø1£©ŅĄ¾ŻĢāŅāÖ½ÕÅ»į·¢ÉśĖįŠŌøÆŹ“¶ų±ä“ą”¢ĘĘĖš£¬½įŗĻĆ÷·ÆĖ®½āĻŌĖįŠŌ¼°Ģ¼ĖįøĘÄÜÖŠŗĶH+£¬æÉ·ĄÖ¹Ö½ÕŵÄĖįŠŌøÆŹ“£¬¾Ż“Ė½ā“š£»
£Ø2£©¢ŁĻĖĪ¬ĖŲŌŚ¼īŠŌĢõ¼žĻĀĶ¬ŃłŅ²ÄÜ·¢ÉśĖ®½ā£¬Ņņ“ĖÅēČ÷¼īŠŌČÜŅŗĶ¬ŃłŅ²ÄÜŌģ³ÉŹé¼®ĪŪĖš£»
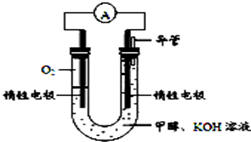
¢ŚÓÉĢāŅā£ŗÅēČ÷Zn£ØC2H5£©2£®Zn£ØC2H5£©2æÉŅŌÓėĖ®·“Ӧɜ³ÉŃõ»ÆŠæŗĶŅŅĶ飬Ńõ»ÆŠæÄܹ»ÓėĒāĄė×Ó·“Ó¦£¬ĻūŗÄĒāĄė×Ó£¬¾Ż“ĖŠ“³ö·“Ó¦·½³ĢŹ½ŗĶĄė×Ó·½³ĢŹ½£»
£Ø3£©·ÖĪö·“Ó¦ÖŠø÷ŌŖĖŲ»ÆŗĻ¼Ū±ä»Æ£¬ÕŅ³öŌŖĖŲ»ÆŗĻ¼ŪÉżøßµÄŌŖĖŲŗĶ»ÆŗĻ¼Ū½µµĶµÄŌŖĖŲ£¬ŅĄ¾ŻŃõ»Æ»¹Ō·“Ó¦ÖŠµĆŹ§µē×ÓŹŲŗć¹ęĀɽįŗĻŌ×ÓøöŹżŹŲŗć¹ęĀɏ銓·½³ĢŹ½£®
½ā“š ½ā£ŗ£Ø1£©ŅĄ¾ŻĢāŅāÖ½ÕÅ»į·¢ÉśĖįŠŌøÆŹ“¶ų±ä“ą”¢ĘĘĖš£¬¶ųĆ÷·ÆĖ®½ā²śÉśĖįŠŌ»·¾³£¬ŌŚĖįŠŌĢõ¼žĻĀĻĖĪ¬ĖŲĖ®½ā£¬Ź¹øß·Ö×ÓĮ“¶ĻĮŃ£»Ģ¼ĖįøĘÄܹ»ĻūŗÄČÜŅŗÖŠĒāĄė×Ó£¬¼õČõČÜŅŗĖįŠŌ£¬·“Ó¦Ąė×Ó·½³ĢŹ½£ŗCaCO3+2H+=Ca2++CO2”ü+H2O£»
¹Ź“š°øĪŖ£ŗĆ÷·ÆĖ®½ā²śÉśĖįŠŌ»·¾³£¬ŌŚĖįŠŌĢõ¼žĻĀĻĖĪ¬ĖŲĖ®½ā£¬Ź¹øß·Ö×ÓĮ“¶ĻĮŃ£» CaCO3+2H+=Ca2++CO2”ü+H2O£»
£Ø2£©¢ŁĻĖĪ¬ĖŲ²»µ«ÄÜŌŚĖįŠŌ»·¾³ĻĀĖ®½ā£¬ŌŚ¼īŠŌĢõ¼žĻĀĶ¬ŃłĖ®½ā£®¹żĮæµÄ¼īĶ¬ŃłæÉÄÜ»įµ¼ÖĀĻĖĪ¬ĖŲĖ®½ā£¬Ōģ³ÉŹé¼®ĪŪĖš£»
¹Ź“š°øĪŖ£ŗ¹żĮæµÄ¼īĶ¬ŃłæÉÄÜ»įµ¼ÖĀĻĖĪ¬ĖŲĖ®½ā£¬Ōģ³ÉŹé¼®ĪŪĖš£»
¢ŚÓÉŠÅĻ¢æÉÖŖ£ŗZn£ØC2H5£©2æÉŅŌÓėĖ®·“Ӧɜ³ÉŃõ»ÆŠæŗĶŅŅĶ飬Ę䏵·“Ó¦ŌĄķĻąæÉ擳Ɋæ½įŗĻĖ®µēĄė³öĄ“µÄĒāŃõøł£¬×īŗó±äĪŖŃõ»ÆŠæŗĶĖ®£¬ŌņC2H5½įŗĻĒā±äĪŖŅŅĶ飮Ńõ»ÆŠææÉŅŌÓėĖįŠŌČÜŅŗ·“Ó¦£¬“Ó¶ųĻūŗĵōĒāĄė×Ó£¬Ęšµ½·ĄÖ¹øÆŹ“µÄ×÷ÓĆ£®
¹Ź“š°øĪŖ£ŗZn£ØC2H5£©2+H2O=ZnO+2C2H6”ü£»ZnO+2H+=Zn2++H2O£»
£Ø3£©¢ŁĮīFeTiO3µÄĻµŹżĪŖ1£¬øł¾ŻTiŌ×ÓŹŲŗćæÉÖŖ£¬TiCl4µÄĻµŹżĪŖ1£¬ÓÉFeŌ×ÓŹŲŗćæÉÖŖFeCl3µÄĻµŹżĪŖ1£¬ÓÉOŌ×ÓŹŲŗćæÉÖŖCOµÄĻµŹżĪŖ3£¬øł¾ŻCŌ×ÓŹŲŗćæÉÖŖCµÄĻµŹżĪŖ3£¬øł¾ŻClŌ×ÓŹŲŗćæÉÖŖĀČĘųµÄĻµŹżĪŖ$\frac{7}{2}$£¬Ķ¬Ź±Ą©“ó2±¶£¬ÅäĘ½ŗó·½³ĢŹ½ĪŖ£ŗ2FeTiO3+6C+7Cl2+6C$\frac{\underline{\;900”ę\;}}{\;}$2TiCl4+2FeCl3+6CO£¬
¹Ź“š°øĪŖ£ŗ2£¬6£¬7£»2£¬2£¬6£»
¢Ś·“Ó¦ÖŠCl£ŗ-1¼Ū”ś0¼Ū£¬O£ŗ0¼Ū”ś-2¼Ū£¬ŅŖŹ¹Ńõ»Æ¼Į”¢»¹Ō¼ĮµĆŹ§µē×ÓŹŲŗć£¬ŌņTiCl4µÄĻµŹżĪŖ1£¬O2ĻµŹżĪŖ1£¬ŅĄ¾ŻŌ×ÓøöŹżŹŲŗć£¬TiO2ĻµŹżĪŖ1£¬Cl2ĻµŹżĪŖ2£¬·½³ĢŹ½£ŗTiCl4+O2$\frac{\underline{\;1000”ę-1400”ę\;}}{\;}$TiO2+2Cl2£»
¹Ź“š°øĪŖ£ŗ1£»1£»1£»2£®
µćĘĄ ±¾Ģāæ¼²éĮĖ»Æѧ·½³ĢŹ½ŹéŠ“£¬²ąÖŲæ¼²éŃõ»Æ»¹Ō·“Ó¦·½³ĢŹ½ÅäĘ½£¬Ć÷Č·ŃĪĄąĖ®½ā¹ęĀÉ”¢Ńõ»Æ»¹Ō·“Ó¦»ł±¾øÅÄī”¢µĆŹ§µē×ÓŹŲŗć¹ęĀÉŹĒ½āĢā¹Ų¼ü£¬ĢāÄæÄѶČÖŠµČ£®


 »ĘøŌĢģĢģĮ·æŚĖćĢāæØĻµĮŠ“š°ø
»ĘøŌĢģĢģĮ·æŚĖćĢāæØĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | “Ö¹čÖʱøµ„¾§¹č²»Éę¼°Ńõ»Æ»¹Ō·“Ó¦ | |
| B£® | ¹čŹĒ¹¹³ÉæóĪļŗĶŃŅŹÆµÄÖ÷ŅŖŌŖĖŲ£¬¹čŌŚµŲæĒÖŠµÄŗ¬ĮæŌŚĖłÓŠµÄŌŖĖŲÖŠ¾ÓµŚŅ»Ī» | |
| C£® | ¹čµÄ»ÆѧŠŌÖŹ²»»īĘĆ£¬ŌŚ×ŌČ»½ēÖŠæÉŅŌŅŌÓĪĄėĢ¬“ęŌŚ | |
| D£® | ¹čŌŚµē×Ó¹¤ŅµÖŠ£¬ŹĒÖŲŅŖµÄ°ėµ¼Ģå²ÄĮĻ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 95”ę“æĖ®µÄpH£¼7£¬ĖµĆ÷¼ÓČČæɵ¼ÖĀĖ®³ŹĖįŠŌ | |
| B£® | ÓĆpHŹŌÖ½²āČÜŅŗµÄpHŹ±£¬ŠčĻČÓĆÕōĮóĖ®ČóŹŖŹŌÖ½ | |
| C£® | 0.2 mol/LµÄŃĪĖįÓėµČĢå»żĖ®»ģŗĻŗópHŌ¼ĪŖ1 | |
| D£® | 25”ꏱ£¬pH=12µÄ°±Ė®ČÜŅŗÓėpH=2µÄŃĪĖįµČĢå»ż»ģŗĻŗópH=7 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ”°µĶĢ¼Ń»·”±ŅżĘšø÷¹śµÄø߶ČÖŲŹÓ£¬¶ųČēŗĪ½µµĶ“óĘųÖŠCO2µÄŗ¬Įæ¼°ÓŠŠ§µŲæŖ·¢ĄūÓĆCO2£¬ŅżĘšĮĖČ«ŹĄ½ēµÄĘÕ±éÖŲŹÓ£®ĖłŅŌ”°µĶĢ¼¾¼Ć”±Õż³ÉĪŖæĘѧ¼ŅŃŠ¾æµÄÖ÷ŅŖæĪĢā
”°µĶĢ¼Ń»·”±ŅżĘšø÷¹śµÄø߶ČÖŲŹÓ£¬¶ųČēŗĪ½µµĶ“óĘųÖŠCO2µÄŗ¬Įæ¼°ÓŠŠ§µŲæŖ·¢ĄūÓĆCO2£¬ŅżĘšĮĖČ«ŹĄ½ēµÄĘÕ±éÖŲŹÓ£®ĖłŅŌ”°µĶĢ¼¾¼Ć”±Õż³ÉĪŖæĘѧ¼ŅŃŠ¾æµÄÖ÷ŅŖæĪĢā| ŹµŃé×é | ĪĀ¶Č”ę | ĘšŹ¼Įæ/mol | Ę½ŗāĮæ/mol | “ļµ½Ę½ŗāĖłŠčŹ±¼ä/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
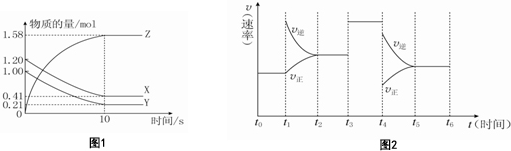
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com