
| A. | 补血营养品红桃K中添加微量铁粉,作为补铁剂 | |
| B. | 中秋月饼包装袋内有小袋铁粉,作为干燥剂 | |
| C. | 苏打饼干包装盒中有小袋生石灰,作为补钙剂 | |
| D. | 卤制品中加入大量亚硝酸钠,作为保鲜剂 |
分析 A、根据微量铁粉能与胃酸中的盐酸反应生成已被人体吸收的亚铁盐,进行分析判断;
B、铁粉能吸收氧气和水分,生成铁锈,据此进行分析判断;
C、根据生石灰能与水反应生成氢氧化钙,进行分析判断;
D、根据亚硝酸钠有毒进行分析判断.
解答 解:A、微量铁粉能与胃酸中的盐酸反应生成已被人体吸收的亚铁盐,补血营养品红桃K中添加微量铁粉,作为补铁剂,故A正确;
B、中秋月饼包装袋内有小袋铁粉,铁粉能吸收氧气和水分,生成铁锈,能防止食品腐败、保持食品干燥,不只是作为干燥剂,故B错误;
C、生石灰能与水反应生成氢氧化钙,苏打饼干包装盒中有小袋生石灰,作为干燥剂,故C错误;
D、亚硝酸钠有毒,能作防腐剂,但应适量使用(符合国家标准),卤制品中不能加入大量亚硝酸钠,故D错误.
故选:A.
点评 本题难度不大,掌握常见的食品干燥剂、微量元素的摄入方法、亚硝酸钠的性质等是正确解答本题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 | |
| B. | 若单位时间内生成x mol N2的同时,消耗2x molNH3,则反应达到平衡状态 | |
| C. | 达到化学平衡时,2v (H2) 正=3v (NH3) 逆 | |
| D. | 加入催化剂,正反应速率增大,逆反应速率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO的燃烧热为-283 kJ•mol-1 | |
| B. | CO的燃烧热为566 kJ•mol-1 | |
| C. | CO的燃烧热△H=-283 kJ•mol-1 | |
| D. | 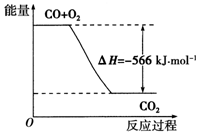 如图可表示由CO生成CO2的反应过程和能量关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 肼(N2H2)是火箭常用的高能燃料,常温下为液体,其球棍模型如图所示.肼能与双氧水发生反应:N2H4+2H2O2═N2+4H2O.用NA表示阿伏伽德罗常数,下列说法正确的是( )
肼(N2H2)是火箭常用的高能燃料,常温下为液体,其球棍模型如图所示.肼能与双氧水发生反应:N2H4+2H2O2═N2+4H2O.用NA表示阿伏伽德罗常数,下列说法正确的是( )| A. | 标准状况下,11.2LN2中含电子总数为5NA | |
| B. | 标准状况下,22.4LN2H4中所含原子总数为6NA | |
| C. | 标准状况下,3.2gN2H4中含有共价键的总数为0.6NA | |
| D. | 若生成3.6gH2O,则上述反应转移电子的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、HCO3-、CO32-、Br- | B. | SO32-、HSO3-、OH-、K+ | ||
| C. | Fe3+、Cu2+、NO3-、SO32- | D. | H+、Na+、NO3-、Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,其中氮的化合价为-2;
,其中氮的化合价为-2;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 打开汽水瓶盖,冒出大量气泡 | |
| B. | 实验室常用排饱和食盐水法收集Cl2 | |
| C. | 平衡体系2NO2?N2O4△H<0,升高温度,颜色变深 | |
| D. | 平衡体系H2(g)+I2(g)?2HI(g),缩小体积,颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10g H2和10g O2 | B. | 5.6LN2(标准状况)和11gCO2 | ||
| C. | 9g H2O和1mol Br2 | D. | 224ml H2(标准状况)和0.1mol N2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com