

分析 流程分析:第①步加酸溶解生成TiO2+和Fe2+,第②步加铁粉还原Fe3+,过滤除去滤渣,第③步冷却结晶,过滤得到FeSO4•7H2O和含有TiO2+的溶液;第④步调节PH,使TiO2+水解生成Ti(OH)4,过滤得到Ti(OH)4;第⑤步Ti(OH)4受热分解生成化生成TiO2.
(1)FeTiO3与H2SO4反应生成FeSO4、TiOSO4和H2O;
(2)步骤③中,利用绿矾与TiOSO4的溶解性的差异实现混合物的分离;
(3)步骤②、③、④中均为分离固液混合物的操作;根据过滤的操作过程和仪器组装来判断用到什么仪器;
(4)升高温度促进水解平衡正移;
(5)生产过程中的废液含有Fe2+,与MnO2发生氧化还原反应.
解答 解:(1)钛铁矿粉主要成分的化学式为FeTiO3,其中铁元素的化合价为+2价,氧元素的化合价为-2价,钛的化合价为+4价,黑钛液中生成的主要阳离子有TiO2+和Fe2+,FeTiO3与H2SO4反应生成FeSO4、TiOSO4和H2O,则其化学反应方程式为:FeTiO3+2H2SO4═FeSO4+TiOSO4+2H2O;亚铁离子易被氧化,则加入铁粉的主要目的是将Fe3+转化为Fe2+并防止Fe2+被氧化;
故答案为:FeTiO3+2H2SO4═FeSO4+TiOSO4+2H2O;将Fe3+转化为Fe2+并防止Fe2+被氧化;
(2)步骤③中,利用绿矾与TiOSO4的溶解性的差异实现混合物的分离,把混合物的溶液冷却结晶得到绿矾固体,
故答案为:b;
(3)步骤②、③、④中均为分离固液混合物的操作,则操作为过滤,灼烧固体一般在坩埚中进行,过滤时需要制作过滤器的漏斗、固定仪器的铁架台、引流用的玻璃棒、承接滤液的烧杯,
故答案为:过滤;烧杯、漏斗、玻璃棒;
(4)TiO2+在一定条件下会发生水解生成Ti(OH)4和氢离子,溶液中存在平衡:TiO2++3H2O?Ti(OH)4+2H+,升高温度促进水解平衡正移,生成Ti(OH)4;
故答案为:溶液中存在平衡:TiO2++3H2O?Ti(OH)4+2H+,当加入热水稀释、升温后,平衡正向移动,生成Ti(OH)4;
(5)生产过程中的废液含有Fe2+,与MnO2发生氧化还原反应生成硫酸锰,其反应的离子方程式为:MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O,
故答案为:MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O.
点评 本题考查了物质制备流程分析判断,实验基本操作,离子方程式的书写等,考查学生对所学知识的综合应用能力,注意物质分离的流程分析判断,物质性质的应用,题目难度中等.


科目:高中化学 来源: 题型:解答题
 ,并推测1mol NH4BF4(氟硼酸铵)中含有2NA个配位键.
,并推测1mol NH4BF4(氟硼酸铵)中含有2NA个配位键.
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
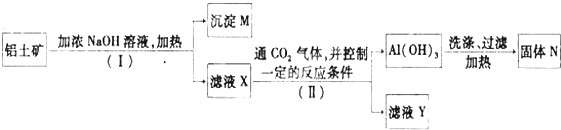
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺磺化得到:
对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺磺化得到: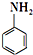 +H2SO4$\stackrel{170-180℃}{→}$
+H2SO4$\stackrel{170-180℃}{→}$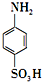 +H2O
+H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  表示某吸热反应分别在有、无催化剂的情况况下反应过程中的能量变化 | |
| B. |  表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的物质的量与NaOH溶液体积的关系,则三种离子的物质的量之比比为(Mg2+):(Al3+):n(NH4+)=2:3:2 | |
| C. | 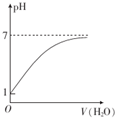 表示常温下0.10 mol•L-1的CH3COOH溶液加水稀释时溶液的pH变化 | |
| D. |  表示向10.00 mL 0.050 mol•L-1盐酸中逐滴加人0.025 mol•L-1的氨水时溶液的pH变化,其中 V1>20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲烷的熔沸点比硅烷的低 | |
| B. | NH3易液化 | |
| C. | NH3分子比PH3分子稳定 | |
| D. | 在相同条件下,H2O的沸点比H2S的沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
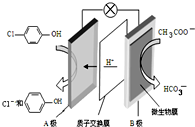 污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚(
污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚( ),其原理如图所示,下列说法不正确的( )
),其原理如图所示,下列说法不正确的( )| A. | 电流方向从B极沿导线经小灯泡流向A极 | |
| B. | A为电池的正极,发生还原反应 | |
| C. | A极的电极反应式为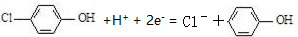 | |
| D. | 当外电路中有0.2mole-转移时,进入A极区的H+的个数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com