
| A.Cu | B.Mg | C.Fe | D.Al |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.Al2O3 | B.Al(OH)3 | C.AlCl3 | D.Al |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | A | B | C | D |
| X | CO2 | HCl | NaOH | AlCl3 |
| Y | Ca(OH)2 | NaAlO2 | AlCl3 | NaOH |
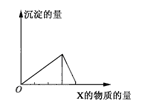
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.72ml | B.80ml | C.90ml | D.120ml |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
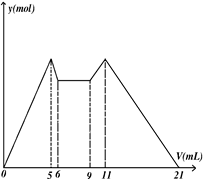
| A.横坐标从5到6溶液中Al3+浓度在上升 |
| B.原混合液中,c(Al3+)∶c(Mg2+)∶c(Cl—)=1∶1∶5 |
| C.A是NaOH,B是盐酸,且c(NaOH)∶c(HCl)=2∶1 |
| D.横坐标从6到9,相应离子反应式H++OH— =H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2∶3 | B.1∶1 | C.1∶2 | D.1∶3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
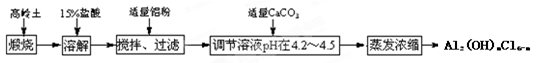
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com