
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g)![]() CH3OH(g)△H1=-90.7 kJ·mol-1
CH3OH(g)△H1=-90.7 kJ·mol-1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g)△H2=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g)△H2=-23.5kJ·mol-1
③CO(g)+H2O(g)![]() CO2(g)+H2(g)△H3=-41.2 kJ·mol-1
CO2(g)+H2(g)△H3=-41.2 kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的△H=_____________kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H=_____________kJ·mol-1。
(2)在不同温度下按照相同物质的量投料发生反应①,测得CO的平衡转化率与压强的关系如图所示,下列说法正确的是_____________。

A.反应温度:T1>T2 B.正反应速率:υ正(y)=υ正(w)
C.混合气体密度:ρ(x)>ρ(w) D.混合气体平均摩尔质量:M(y)<M(z)
E.该反应的△S<0、△H<0,所以能在较低温度下自发进行
(3)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(DME)。如图回答问题;催化剂中![]() 约为_____________时最有利于二甲醚的合成。
约为_____________时最有利于二甲醚的合成。

(4)高温时二甲醚发生分解反应:CH3OCH3![]() CH4+CO+H2。迅速将二甲醚引入一个504℃的抽成真空的瓶中,在不同时刻t测定瓶内压强P总如下表。
CH4+CO+H2。迅速将二甲醚引入一个504℃的抽成真空的瓶中,在不同时刻t测定瓶内压强P总如下表。
t/min | 0 | 10 | 20 | 30 | 40 | 50 |
P总/kPa | 50.0 | 78.0 | 92.0 | 99.0 | 100 | 100 |
①该反应的平衡常数表达式为Kp=_____________。
②该反应的平衡常数Kp=_____________。(带单位。某一物质的平衡分压=总压×物质的量分数)
(5)一种以二甲醚作为燃料的燃料电池的工作原理如图所示。则其负极的电极反应式为_______________。该电池的理论输出电压为1.20V,则其能量密度E=_____________(列式计算。能量密度=电池输出电能/燃料质量,1kW·h=3.6×106J,法拉第常数F=96500C·mol-1)。

【答案】 -246.1 CE 2.0 ![]() 625kPa2 CH3OCH3-12e-+3H2O=2CO2+12H+
625kPa2 CH3OCH3-12e-+3H2O=2CO2+12H+ ![]() (3.6×106J·kW-l·h-1)=8.39kW·h·kg-1
(3.6×106J·kW-l·h-1)=8.39kW·h·kg-1
【解析】分析:本题考查盖斯定律的应用、化学平衡图像的分析、化学平衡常数的计算、燃料电池的工作原理和计算。
(1)应用盖斯定律,将①![]() 2+②+③消去CH3OH(g)和H2O(g)。
2+②+③消去CH3OH(g)和H2O(g)。
(2)反应①的特点是:正反应为气体分子数减小的放热反应;压强相同时,升高温度反应①平衡向逆反应方向移动,CO的平衡转化率减小,气体分子物质的量增大,混合气体密度减小,混合气体的平均摩尔质量减小;温度相同时,增大压强化学反应速率加快,平衡向正反应方向移动;能自发进行的反应的ΔG=ΔH-TΔS![]() 0。
0。
(3)图像中![]() 约为2.0时,DME选择性最高,CO转化率最大,为合成二甲醚的最佳条件。
约为2.0时,DME选择性最高,CO转化率最大,为合成二甲醚的最佳条件。
(4)40min和50min时P总相等,平衡时P总=100kPa,用三段式和Kp的表达式计算平衡常数。
(5)电解质为酸性,负极反应式为:CH3OCH3-12e-+3H2O=2CO2+12H+。能量密度=电池输出电能/燃料质量,计算1kg二甲醚参与反应时电池输出电能即可。根据法拉第电解定律计算电量Q(Q=znF,其中z代表电极反应式中以1mol物质为基准转移电子的计量数,n为电极反应式中消耗或析出物质物质的量,F为法拉第常数),由电量计算电功W(W=QU,W代表电功,Q代表电量,U代表电压),电功进行单位换算得出电池输出电能。
详解:(1)应用盖斯定律,①![]() 2+②+③得3H2(g)+3CO(g)
2+②+③得3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)ΔH=(-90.7kJ/mol)
CH3OCH3(g)+CO2(g)ΔH=(-90.7kJ/mol)![]() 2+(-23.5kJ/mol)+(-41.2kJ/mol)=-246.1kJ/mol。
2+(-23.5kJ/mol)+(-41.2kJ/mol)=-246.1kJ/mol。
(2)A项,反应①的正反应为放热反应,升高温度平衡向逆反应方向移动,CO的平衡转化率减小,在横坐标上任取一点作纵坐标的平行线与曲线相交,可见CO的平衡转化率依T1、T2、T3顺序减小,则反应温度:T3![]() T2
T2![]() T1,A项错误;B项,y点和w点温度相同,y点压强大于w点压强,其他条件相同时有气体参与的反应压强越大反应速率越快,正反应速率:υ正(y)
T1,A项错误;B项,y点和w点温度相同,y点压强大于w点压强,其他条件相同时有气体参与的反应压强越大反应速率越快,正反应速率:υ正(y)![]() υ正(w),B项错误;C项,x点、w点压强相同,x点的温度低于w点的温度,温度升高反应①向逆反应方向移动,x点平衡时气体分子物质的量小于w点,根据PV=nRT,平衡时x点容器的体积小于w点,根据质量守恒定律,x点、w点气体的质量相等,混合气体的密度:ρ(x)
υ正(w),B项错误;C项,x点、w点压强相同,x点的温度低于w点的温度,温度升高反应①向逆反应方向移动,x点平衡时气体分子物质的量小于w点,根据PV=nRT,平衡时x点容器的体积小于w点,根据质量守恒定律,x点、w点气体的质量相等,混合气体的密度:ρ(x)![]() ρ(w),C项正确;D项,y点、z点压强相同,y点温度低于z点,温度升高反应①向逆反应方向移动,y点平衡时气体分子物质的量小于z点,根据质量守恒定律,y点、z点气体的质量相等,混合气体平均摩尔质量:M(y)
ρ(w),C项正确;D项,y点、z点压强相同,y点温度低于z点,温度升高反应①向逆反应方向移动,y点平衡时气体分子物质的量小于z点,根据质量守恒定律,y点、z点气体的质量相等,混合气体平均摩尔质量:M(y)![]() M(z),D项错误;E项,该反应①的ΔH
M(z),D项错误;E项,该反应①的ΔH![]() 0,该反应的正反应为气体分子数减小的反应即ΔS
0,该反应的正反应为气体分子数减小的反应即ΔS![]() 0,该反应自发进行时ΔH-TΔS
0,该反应自发进行时ΔH-TΔS![]() 0,该反应自发进行的条件是低温,E项正确;答案选CE。
0,该反应自发进行的条件是低温,E项正确;答案选CE。
(3)根据图像催化剂中![]() 约为2.0时,CO的转化率最大、DME选择性最大,催化剂中
约为2.0时,CO的转化率最大、DME选择性最大,催化剂中![]() 约为2.0时最有利于二甲醚的合成。
约为2.0时最有利于二甲醚的合成。
(4)①根据平衡常数的概念,反应CH3OCH3![]() CH4+CO+H2的平衡常数表达式Kp=
CH4+CO+H2的平衡常数表达式Kp=![]() 。
。
②设起始充入的CH3OCH3物质的量为amol,从起始到平衡转化CH3OCH3物质的量为xmol,用三段式:CH3OCH3![]() CH4+CO+H2
CH4+CO+H2
n(起始)(mol) a 0 0 0
n(转化)(mol) x x x x
n(平衡)(mol) a-x x x x
根据表中数据,起始时P总为50.0kPa,40min和50min时P总相等,平衡时P总=100kPa,则![]() =
=![]() ,解得x=
,解得x=![]() ,平衡时CH3OCH3、CH4、CO、H2物质的量都为
,平衡时CH3OCH3、CH4、CO、H2物质的量都为![]() mol,各物质物质的量分数都为
mol,各物质物质的量分数都为![]() ,平衡时CH3OCH3、CH4、CO、H2的分压都为100kPa
,平衡时CH3OCH3、CH4、CO、H2的分压都为100kPa![]() =25kPa,该反应的平衡常数Kp=
=25kPa,该反应的平衡常数Kp=![]() =
=![]() =625kPa2。
=625kPa2。
(5)根据装置图,该二甲醚燃料电池中电解质为酸性,在负极二甲醚发生氧化反应生成CO2,负极电极反应式为CH3OCH3-12e-+3H2O=2CO2+12H+。设消耗二甲醚1kg,根据负极电极反应式,每消耗1molCH3OCH3转移12mol电子,根据法拉第电解定律计算Q=znF=12![]() 96500C/mol,电功W=UQ=1.2V
96500C/mol,电功W=UQ=1.2V![]() 12
12![]() 96500C/mol,根据换算公式1kW·h=3.6
96500C/mol,根据换算公式1kW·h=3.6![]() 106J,电池输出电能为1.2V
106J,电池输出电能为1.2V![]() 12
12![]() 96500C/mol
96500C/mol![]() (3.6
(3.6![]() 106J·kW-1·h-1),能量密度E=电池输出电能/燃料质量=1.2V
106J·kW-1·h-1),能量密度E=电池输出电能/燃料质量=1.2V![]() 12
12![]() 96500C/mol
96500C/mol![]() (3.6
(3.6![]() 106J·kW-1·h-1)
106J·kW-1·h-1)![]() 1kg=8.39kW·h·kg-1。
1kg=8.39kW·h·kg-1。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.通过灼烧时产生的气味可以鉴别蚕丝和棉纱
B.淀粉和纤维素互为同分异构体
C.人的皮肤上不慎沾染浓硝酸后变黄色是物理变化
D.蛋白质溶液中加入饱和硫酸铵溶液,会使蛋白质变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、稀盐酸、澄清石灰水、氯化铜溶液是常见的物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )
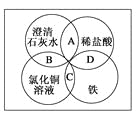
A. OH-+HCl===H2O+Cl-
B. Ca(OH)2+Cu2+===Ca2++Cu(OH)2
C. Fe+Cu2+===Cu+Fe2+
D. Fe+2H+===Fe3++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开放以来,人民生活水平不断提高,更加讲究合理膳食。下列饮食习惯科学的是
A. 多吃肉,少吃蔬菜水果 B. 多饮纯净水,少饮矿泉水
C. 多食用含防腐剂的食品 D. 注饮食的合理搭配
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有两只密闭容器A和B,A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量SO3气体,并使A和B容积相等(如图所示)。保持400℃条件下发生反应:2SO2+O2![]() 2SO3。则下列描述正确的是( )
2SO3。则下列描述正确的是( )

A. 达到平衡所需要的时间:A容器更短
B. 达到平衡时:B容器中SO3的转化率更大
C. 达到平衡时:A容器中SO2的物质的量更多
D. 达到平衡后,向两容器中分别通入等量的氦气,A容器中SO3的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子一定能够大量共存的是( )
A. 中性溶液:Mg2+、Al3+、HCO3-、SO42-
B. c(H+)水=10-12 mol·L-1的溶液:Na+、K+、CO32-、SO42-
C. 0.1 mol·L-1的FeCl3溶液:K+、Cu2+、SO32-、NO3-
D. 常温下![]() =1×10-12的溶液:K+、[Al(OH)4]-、CO32-、Na+
=1×10-12的溶液:K+、[Al(OH)4]-、CO32-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2.0L的恒容密闭容器中分别加入一定量的X,发生反应:pX(g) ![]() Y(g)+Z(g),相关数据如下表所示:
Y(g)+Z(g),相关数据如下表所示:
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
X(g) | Y(g) | Z(g) | ||
Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | 0.160 | 0.160 |
Ⅲ | T | 0.20 | 0.090 | 0.090 |
回答下列问题:
(1)若容器Ⅰ中反应经10min达到平衡,则前10min内Y的平均反应速率v(Y)=___________。容器Ⅰ和容器Ⅱ中起始时X的反应速率v(X)Ⅰ___________v(X)Ⅱ(填“大于”“小于”或“等于”)。
(2)已知该正反应为放热反应,则T___________387(填“大于”或“小于”),判断理由是___________。
(3)反应方程式中X的化学计量数p的取值为___________,容器Ⅱ中X的平衡转化率为___________。若起始时向容器Ⅰ中充入0.1molX、0.15molY和0.10molZ,则反应将向___________ (填“正”或“逆”)反应方向进行,判断理由是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温时通过以下反应制备金属铝。用铝制作的“快速放电铝离子二次电池”的原理如右图所示(EMI+为有机阳离子)。

①Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g) ΔH1=a kJ·mol-1
②3AlCl(g)===2Al(l)+AlCl3(g) ΔH2=b kJ·mol-1
③Al2O3(s)+3C(s)===2Al(l)+3CO(g) ΔH3
下列说法正确的是( )
A. ΔH3<0
B. Al2O3(s)+3C(s)===2Al(l)+3CO(g) ΔH3=(a-b) kJ·mol-1
C. 该电池充电时石墨电极与电源负极相连
D. 该电池放电时的负极反应方程式为Al-3e-+7AlCl===4Al2Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com