
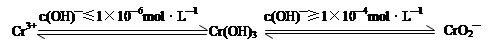



 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题

| A.M点时生成的CO2为0mol |
| B.原混合溶液中的CO32-与AlO2-的物质的量之比为1:2 |
| C.V1:V2=1:4 |
| D.a曲线表示的离子方程式为:AlO2-+H+ + H2O=Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
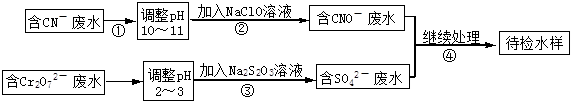 回答以下问题:
回答以下问题:| A.1 | B.1/2 | C.2 | D.不能确定 |
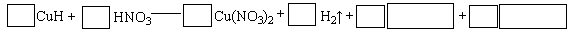
查看答案和解析>>
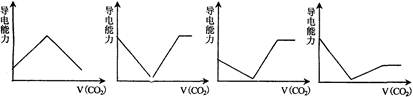
科目:高中化学 来源:不详 题型:单选题
| A.x=10时,溶液中有NH4+、Al3+、SO42-,且c(SO42-)>c(NH4+)>c(Al3+) |
| B.x=20时溶液导电能力比x=15时溶液导电能力强 |
| C.x=25时,溶液中主要有Ba2+、AlO2-,c(Ba2+)>c(AlO2-) |
| D.x=30时的离子方程式:NH4++Al3++2SO42-+2Ba2++5OH-→AlO2-+2BaSO4↓+NH3?H2O+2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入盐酸产生无色气体,将气体通入石灰水中,溶液变浑浊,一定有CO32- |
| B.向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42- |
| C.滴加KSCN溶液后呈红色,一定有Fe3+ |
| D.加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ba2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com