
【题目】测定有机物中碳和氢的质量分数,常用的方法是燃烧分析法,用氧化铜作催化剂,在750 ℃左右使有机物在氧气流中全部氧化成CO2和H2O,分别用装有固体NaOH和固体Mg(ClO4)2(高氯酸镁)的吸收管吸收CO2和H2O。某课外活动小组,设计用下列装置制取乙烯,并测定乙烯分子中碳、氢原子个数比,甲为燃烧管,当乙烯和氧气通过时,由于催化剂的存在而不会发生爆炸,乙烯将被氧化成CO2和H2O。
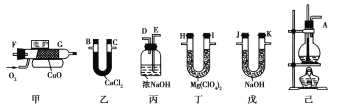
请回答下列问题:
(1)整套装置的连接顺序(按从左到右顺序用字母填写): ____接____,____接____,____接____,____接____,____接___.
(2)烧瓶中的试剂是浓H2SO4和酒精,其中浓H2SO4的作用是___________,在烧瓶中还要加少量碎瓷片,其作用是__________。
(3)实验时应使烧瓶中溶液温度迅速升至170 ℃,原因是____________________。实验结束时,烧瓶中有黑色物质生成,其原因是__________。
(4)乙、丙装置的作用分别是:乙:____________________;丙:_____________________。
(5)若实验前后,丁增重a g,戊增重b g,则测得乙烯分子中C、H原子个数比为__________。
(6)若测得C/H值偏高,导致这种误差的可能原因是(_____)
A.乙烯中混有少量乙醚(C2H5OC2H5)
B.乙烯进入燃烧管时,仍含有少量水蒸气
C.乙烯中混有少量CO
D.乙烯进入燃烧管时,仍含有少量CO2
(7)若仍用上述装置测定某烃A的化学式,经测定丁增重4.5 g,戊增重8.8 g,则A的最简式为__________;若要确定A的化学式,是否还需要其他数据(若需要,说明还需测定哪些数据;若不需要,说明其原因)?_______________________________。
【答案】A E D B C F G H I J 催化剂和脱水剂 防暴沸 防止生成乙醚 浓硫酸的脱水性使乙醇脱水为炭 干燥乙烯 除去乙烯中的杂质气体 ![]() CD CH3 当分子式含2个碳时,碳已被氢饱和,故可直接得到烃的分子式为C2H6,故不需要其他数据
CD CH3 当分子式含2个碳时,碳已被氢饱和,故可直接得到烃的分子式为C2H6,故不需要其他数据
【解析】
(1)根据先制取乙烯、除去乙烯中二氧化碳、二氧化硫并干燥乙烯、乙烯与氧气反应、吸收燃烧生成水、吸收燃烧生成的二氧化碳的顺序对该装置进行排序;
(2)浓硫酸在反应中起催化剂和脱水剂作用,加热液体混合物,为防暴沸,需加碎瓷片;
(3)反应过程中在140°C时会反应生成乙醚副产物;乙醇在浓硫酸作用下加热反应过程中发生副反应浓硫酸的脱水性使乙醇脱水为碳;
(4)乙烯和浓硫酸反应有副反应发生,所以要除去乙烯中杂质气体并干燥乙烯;
(5)分析装置和作用可知,丁质量增加ag是有机物燃烧生成的水的质量,戊质量增加bg为有机物燃烧生成的二氧化碳的质量,依据元素守恒计算得到有机物的最简式;
(6)测定乙烯分子中碳、氢原子的个数比偏高说明乙烯气体中有含有碳元素的气体分析判断;
(7)分析装置和作用可知,丁质量增加4.5g是有机物燃烧生成的水的质量,戊质量增加8.8g为有机物燃烧生成的二氧化碳的质量,依据元素守恒计算得到有机物的最简式;根据最简式判断碳是否被氢饱和。
(1)根据实验原理可知,先从乙烯的发生装置己出发,经过装置丙除去乙烯中混有的二氧化碳和二氧化硫,经乙干燥,即A连接E,D连接C,然后加入乙烯的燃烧装置甲,B连接F,吸收二氧化碳和水时,应该先吸收水分,再吸收二氧化碳,所以G连接H、I连接J,故正确的连接顺序为:A→E→D→B→C→F→G→H→I→J,故答案为:A;E;D;B;C;F;G;H;I;J;
(2)浓硫酸在反应中起催化剂和脱水剂作用,加热液体混合物,为防暴沸,需加碎瓷片;故答案为:催化剂和脱水剂;防暴沸;
(3)乙醇在浓硫酸催化作用下在反应过程中140℃时会反应生成乙醚副产物,乙醇在浓硫酸作用下加热反应过程中发生副反应浓硫酸的脱水性使乙醇脱水为炭,故答案为:防止生成乙醚;浓硫酸的脱水性使乙醇脱水为炭;
(4)乙烯和浓硫酸反应有副反应发生,所以要用丙除去乙烯中杂质气体二氧化碳和二氧化硫,用乙干燥乙烯,故答案为:干燥乙烯;除去乙烯中的杂质气体;
(5)分析装置和作用可知,丁质量增加ag是有机物燃烧生成的水的质量,戊质量增加bg为有机物燃烧生成的二氧化碳的质量,n(CO2)=![]() ,n(H2O)=
,n(H2O)=![]() ,有机物中碳元素、氢元素的物质的量之比n(C):n(H)=
,有机物中碳元素、氢元素的物质的量之比n(C):n(H)= ![]() :
:![]() ×2=
×2=![]() ,故答案为:
,故答案为:![]() ;
;
(6)测定乙烯分子中碳、氢原子的个数比偏高说明乙烯气体中有含有碳元素的气体,
A. 乙烯中混有少量的乙醚(C2H5OC2H5),乙醚碳元素和氢元素之比2:5,小于乙烯中碳氢之比2:4,所以混有乙醚会使碳、氢原子的个数比偏低,故A不符合;
B. 乙烯进入燃烧管时,含有少量的水蒸气,会使乙烯混合气体中碳氢元素原子数之比小于2:4,所以混有水会使碳、氢原子的个数比偏低,故B不符合;
C. 乙烯中混有少量的CO,会使乙烯混合气体中碳氢元素原子数之比大于2:4,所以混有一氧化碳会使碳、氢原子的个数比偏高,故C符合;
D. 乙烯进入燃烧管时,含有少量的CO2,会使乙烯混合气体中碳氢元素原子数之比大于2:4,所以混有二氧化碳会使碳、氢原子的个数比偏高,故D符合;
故答案为:CD;
(7)丁质量增加4.5g是有机物燃烧生成的水的质量,戊质量增加8.8g为有机物燃烧生成的二氧化碳的质量,n(CO2)=![]() =0.2mol,n(H2O)=
=0.2mol,n(H2O)=![]() =0.3mol,有机物中碳元素、氢元素的物质的量之比n(C):n(H)=0.2mol:0.6mol=1:3,最简式为CH3,当分子式含2个碳时,碳已被氢饱和,故可直接得到烃的分子式为C2H6,故不需要其他数据。故答案为:CH3;当分子式含2个碳时,碳已被氢饱和,故可直接得到烃的分子式为C2H6,故不需要其他数据。
=0.3mol,有机物中碳元素、氢元素的物质的量之比n(C):n(H)=0.2mol:0.6mol=1:3,最简式为CH3,当分子式含2个碳时,碳已被氢饱和,故可直接得到烃的分子式为C2H6,故不需要其他数据。故答案为:CH3;当分子式含2个碳时,碳已被氢饱和,故可直接得到烃的分子式为C2H6,故不需要其他数据。


科目:高中化学 来源: 题型:
【题目】城市地下潮湿的土壤中常埋有纵横交错的管道和输电线路,当有电流泄漏并与金属管道形成回路时,就会引起金属管道的腐蚀。原理如图所示,但若电压等条件适宜,钢铁管道也可能减缓腐蚀,此现象被称为“阳极保护”。下列有关说法正确的是( )

A.该装置能够将化学能转化为电能
B.管道右端腐蚀比左端快,右端电极反应式为Fe-2e-═Fe2+
C.如果没有外加电源,潮湿的土壤中的钢铁管道比较容易发生析氢腐蚀
D.钢铁“阳极保护“的实质是在阳极金属表面形成一层耐腐蚀的钝化膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四川盛产五倍子。以五倍子为原料可制得化合物A。A的结构简式如下图所示。请解答下列各题:

(1)A的分子式是__________________。
(2)有机化合物B在硫酸催化条件下加热发生酯化反应可得到A。请写出B的结构简式_________________。
(3)请写出A与过量NaOH溶液反应的化学方程式_________________。
(4)有机化合物C是合成治疗禽流感药物的原料之一。C可以看成是B与氢气按物质的量之比1∶2发生加成反应得到的产物。C分子中无羟基与碳碳双键直接相连的结构,它能与溴水反应使溴水褪色。请写出C与溴水反应的化学方程式: _________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度时,将nmol/L氨水滴入10mL1.0mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是( )

A. a点Kw=1.0×10-14
B. 水的电离程度:b>c>a>d
C. b点:c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D. 25℃时,NH4Cl水解常数为(n-1)×10-7(用n表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释实验过程或事实的反应方程式不正确的是( )
A.熔融烧碱时,不能使用普通石英坩埚:SiO2+2NaOH![]() Na2SiO3+H2O
Na2SiO3+H2O
B.红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层:3Fe+4H2O(g)![]() Fe3O4+4H2
Fe3O4+4H2
C.在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+H2O2+2H+=I2+O2↑+2H2O
D.“84”消毒液(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用放出氯气: ClO-+Cl-+2H+=Cl2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】刑法修正案(八)中明确规定2011年5月1日“醉驾入刑”。
(1)酒精在人体肝脏内可转化为多种有害物质,有机物A是其中的一种,对A的结构进行如下
①通过样品的质谱分析测得A的相对分子质量为60;
②经测定,有机物A的核磁共振氢谱示意图如图:

③对A的水溶液进行测定发现该溶液pH<7。根据以上分析,写出A的结构简式___________。
(2)工业酒精是含水约4%的液态乙醇。要在实验室中将工业酒精转化为无水酒精,请回答下列问题:
①下列做法中最不可取的是(填写代号)_ __________。
A.加入过量的生石灰后过滤
B.加入过量的生石灰后蒸馏
C.加入过量的生石灰后分液
②在该方法的实验步骤里,紧挨加热之前的操作是___________,并且对此要注意的问题是______________________。
③用酒精灯作热源,在加热的过程中要适时调整酒精灯的上下或左右位置,目的是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原滴定实验与中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现用0.001 mol·L-1KMnO4酸性溶液滴定未知浓度的无色NaHSO3溶液。反应的离子方程式是2MnO![]() +5HSO
+5HSO![]() +H+=2Mn2++5SO42-+3H2O
+H+=2Mn2++5SO42-+3H2O
填空完成问题:
(1)该滴定实验所需仪器有下列中的____________。
A酸式滴定管(50 mL) B碱式滴定管(50 mL) C量筒(10 mL) D锥形瓶 E铁架台
F滴定管夹 G烧杯 H白纸 I胶头滴管 J漏斗
(2)不能用________(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因________________。
(3)选何种指示剂,说明理由____________________________。
(4)滴定前平视KMnO4溶液液面,刻度为a mL,滴定后俯视液面刻度为b mL,则(b-a)mL比实际消耗KMnO4溶液体积________(填“多”或“少”)。根据(b-a)mL计算得到的待测浓度,比实际浓度________(填“大”或“小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol-1)可用作定影剂、还原剂。利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在_____________中溶解,完全溶解后,全部转移至100 mL的_____________中,加蒸馏水至_______________。
②滴定:取0.00950 mol·L-1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应:Cr2O72-+6I-+14H+=3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32-=S4O62-+2I-。加入淀粉溶液作为指示剂,继续滴定,当溶液_____________________________________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_______%(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A是制取溴苯的实验装置,B、C是改进后的装置。请仔细分析,对比三个装置,回答下列问题:


(1)写出三个装置中发生反应的主要化学方程式:________________。写出B中右边试管中所发生反应的化学方程式:__________________。
(2)装置A和C均采用了长玻璃导管,其作用是_______、____________。
(3)在实验B、C装好仪器及药品后要使反应开始,应对装置B进行的操作是________________;应对装置C进行的操作是_______________________。
(4)装置B、C较好地解决了A中加装药品和使装置及时密封的矛盾,方便了操作。A装置中这一问题在实验中造成的后果是_________________。
(5)B中采用了洗气瓶吸收装置,其作用是______________________,反应后洗气瓶中可能出现的现象是_______________。
(6)B装置也存在两个明显的缺点,使实验的效果不好或不能正常进行。这两个缺点是_____________________;_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com